(10分)1994年度诺贝尔化学奖授予为研究臭氧做出贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3的分子结构如图,呈V型,两个O----O键的夹角为116.5o。三个原子以一个O原子为中心,另外两个O原子分别构成一个共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键------三个O原子均等地享有这个电子。请回答: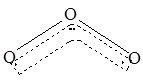
(1)臭氧与氧气的关系是________
(2)写出下列分子与O3分子的结构最相似的是________
| A.H2O | B.CO2 | C.SO2 | D.BeCl2 |
(3)分子中某原子有一对或几对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有________对孤对电子。
(4)O3分子是否为极性分子________。(填是或否)
(5)O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平:
_____ PbS + ____ O3 ="===" _____ PbSO4 + ________ O2
汽车尾气中的NOx是大气污染物之一,科学家们在尝试用更科学的方法将NOx转化成无毒物质,从而减少汽车尾气污染。
(1)压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO2(g) 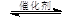 4NO(g)+CO2(g)+2H2O(g) △H1<0
4NO(g)+CO2(g)+2H2O(g) △H1<0
②CH4(g)+4NO(g)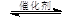 2N2(g)+CO2(g)+2H2O(g) △H2<0
2N2(g)+CO2(g)+2H2O(g) △H2<0
③CH4(g) +2NO2(g)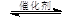 N2(g) +CO2(g) +2H2O(g) △H3= 。(用△H1和△H2表示)
N2(g) +CO2(g) +2H2O(g) △H3= 。(用△H1和△H2表示)
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应③,在不同温度、不同投料比时,NO2的平衡转化率见下表:
| 投料比[n(NO2) / n(CH4)] |
400 K |
500 K |
600 K |
| 1 |
60% |
43% |
28% |
| 2 |
45% |
33% |
20% |
①写出该反应平衡常数的表达式K= 。
②若温度不变,提高[n(NO2) / n(CH4)]投料比,则K将 。(填“增大”、“减小”或“不变”。)
③400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数 。
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示意图如图1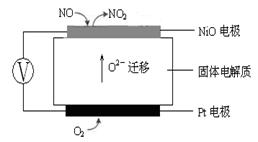
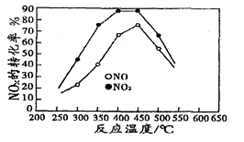
图1图2
①NiO电极上NO发生的电极反应式: 。
②收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V(NO)︰V(NO2)=
(4)在容积相同的两个密闭容器内 (装有等量的某种催化剂) 先各通入等量的CH4,然后再分别充入等量的NO和NO2。在不同温度下,同时分别发生②③两个反应:并在t秒时测定其中NOx转化率,绘得图象如图2所示:
①从图中可以得出的结论是
结论一:相同温度下NO转化效率比NO2的低
结论二:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
结论二的原因是
②在上述NO2和CH4反应中,提高NO2转化率的措施有_________。(填编号)
A.改用高效催化剂 B.降低温度 C.分离出H2O(g) D.增大压强
E.增加原催化剂的表面积 F.减小投料比[n(NO2) / n(CH4)]
2013年10月我市因台风菲特遭受到重大损失,市疾控中心紧急采购消毒药品,以满足灾后需要。复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2是一种无色粘稠液体,请回答下列问题:
(1)下列方程中H2O2所体现的性质与其可以作为消毒剂完全一致的是 。
A.BaO2+2HCl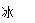 H2O2+BaCl2
H2O2+BaCl2
B.Ag2O+H2O2 =2Ag+O2+H2O
C.2H2O2 2H2O+O2↑
2H2O+O2↑
D.H2O2+NaCrO2+NaOH=Na2CrO4 +H2O
(2)火箭发射常以液态肼(N2H4)为燃料,液态H2O2为助燃剂。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g) △H=" -" 534 kJ·mol-1
H2O2(1)=H2O(1)+1/2O2(g) △H=" -" 98.64 kJ·mol-1
H2O(1)=H2O(g) △H=+44kJ·mol-l
则反应N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)的△H= ,
该反应的△S= 0(填“>”或“<”)。
(3)H2O2是一种不稳定易分解的物质。
①如图是H2O2在没有催化剂时反应进程与能量变化图,请在图上画出使用催化剂加快分解速率时能量与进程图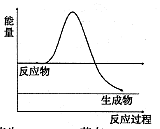
②实验证实,往Na2CO3溶液中加入H2O2也会有气泡产生。已知常温时H2CO3的电离常数分别为Kal=4.3×l0-7,Ka2 =" 5.0" ×l0-11 。Na2CO3溶液中CO32-第一步水解常数表达式Khl= ,常温时Khl的值为 。若在Na2CO3溶液中同时加入少量Na2CO3固体与适当升高溶液温度,则Khl的值
(填变大、变小、不变或不确定)。
(4)某文献报导了不同金属离子及其浓度对双氧水氧化降解海藻酸钠溶液反应速率的影响,实验结果如图1、图2所示。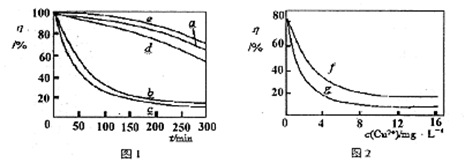
注:以上实验均在温度为20℃、w(H2O2)=0.25%、pH=7.12、海藻酸钠溶液浓度为8mg·L-l的条件下进行。图1中曲线a:H2O2;b:H2O2+Cu2+;c:H2O2+Fe2+;d:H2O2+Zn2+;e:H2O2+Mn2+;图2中曲线f:反应时间为1h;g:反应时间为2h;两图中的纵坐标代表海藻酸钠溶液的粘度(海藻酸钠浓度与溶液粘度正相关)。
由上述信息可知,下列叙述错误的是 (填序号)。
A.锰离子能使该降解反应速率减缓
B.亚铁离子对该降解反应的催化效率比铜离子低
C.海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢
D.一定条件下,铜离子浓度一定时,反应时间越长,海藻酸钠溶液浓度越小
I.“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题:
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1中以v (CO2)表示的反应速率为 (保留两位小数,下同)。
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K= 。
(2)已知在常温常压下:
① 2CH3OH(l)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g)= 2CO2(g)ΔH = -566.0 kJ/mol
③ H2O(g)= H2O(l)ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池某电极的工作原理如下图所示: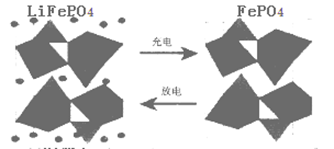
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mole-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是 L,将电解后的溶液加水稀释至1L,此时溶液的pH= 。
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H=" —1214" kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=" —566" kJ/mol
则表示甲烷燃烧热的热化学方程式 。
(2) 将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是: 。
(3)某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)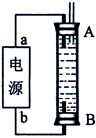
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-= H2↑
(4)将不同量的CO(g)和H2O(g)分别通入体积
为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)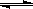 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| H2O |
CO |
CO2 |
|||
| 1 |
650 |
2 |
4 |
1.6 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
3 |
| 3 |
900 |
1 |
2 |
0.4 |
1 |
①实验1中,以v (H2)表示的平均反应速率为 。
②实验3跟实验2相比,改变的条件可能是 (答一种情况即可)
工业合成氨与制备硝酸一般可连续生产,流程如下: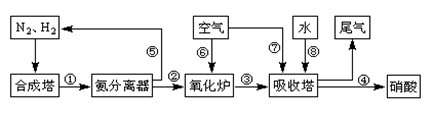
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)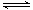 CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g)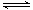 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 300℃(填“>”、“<”或“=”)。
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 300℃(填“>”、“<”或“=”)。
| T/℃ |
T1 |
300 |
T2 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
(3)氨气在纯氧中燃烧生成一种单质和水,科学家利用此原理,设计成“氨气-氧气”燃料电池,则通入氨气的电极是 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 。
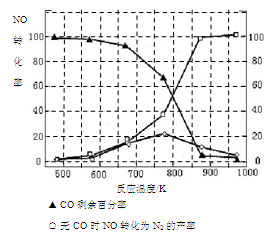
(4)用氨气氧化可以生产硝酸,但尾气中的NOx会污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= -574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= -1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 。
(5)某研究小组在实验室以“Ag-ZSM-5”为催化剂,测得将NO转化为N2的转化率随温度变化情况如图。据图分析,若不使用CO,温度超过775K,发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在 左右。