在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察右图,然后回答问题。
(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应_____________(填“需要”或“不需要”)加热,该反应的△H =______________________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+ O2(g) = 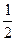 H2O(g) △H =-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·
H2O(g) △H =-241.8 kJ·mol-1,该反应的活化能为167.2 kJ· mol-1,则其逆反应的活化能为____________________。
mol-1,则其逆反应的活化能为____________________。
为了测定氢氧化钠和碳酸钠固体混合物中碳酸钠的质量分数,甲、乙两位同学分别设计了如下的实验方案:
(I)甲同学的方案是:将mg样品溶解,加过量氯化钡溶液,过滤、洗涤、烘干,称得固体ng。
(1)混合物中碳酸钠的质量分数为(用m、n表示),甲同学洗涤沉淀的具体操作是。
(2)Ca2+、Ba2+都可以使CO32-沉淀完全,但使用氯化钡溶液比氯化钙溶液所得的结果具有更高的精确度,原因是:①;
②。
(Ⅱ)乙同学的方案如图所示:
(1)根据乙同学的实验装置图分析,在每次实验中,完成测定过程至少要进行次称量操作。按照该同学的方案进行测定,结果与实际情况存在较大的误差,你认为主要原因可能是(任写两个):
①;
②。
(2)乙同学的方案的装置中存在一定的缺陷,请你提出改进的方法(简单叙述做法,不必画图):。
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
请回答下列问题:
(1)白色沉淀A与试剂②反应的离子方程式是__________________________________。
(2)无色溶液C中加入试剂③的主要目的是____________________________________。
(3)试验中若只加试剂③而不加试剂②,对实验的影响是_______________________。
(4)气体E通入试剂④发生反应的离子方程式是__________________________________。
A、B、C、D、E、R六种元素位于周期表的前四周期,其原子序数依次增大。已知A原子核外有三个未成对电子;B的最外层电子数是内层电子数的3倍;化合物C2E的晶体为离子晶体;D单质的熔点在同周期单质中最高;E原子核外的M层中只有两对成对电子;R原子核外最外层电子数与C相同,其余各层均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D四种原子的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)C的氯化物的熔点比D的氯化物的熔点高,理由是。
(3)基态R+离子的核外电子排布式是。
(4)Q分子是A2B的等电子体,Q的结构式为。
(5)图一是R单质的晶胞结构,配位数为;图二是B、R两元素组成的一种化合物的晶胞,其化学式为。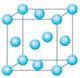
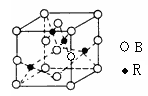
图一图二
按要求回答下列问题:
(1)有下列六种物质:①碳60(C60)晶体②硼晶体③Na2O晶体④ CaF2晶体⑤P4O10晶体⑥碳化硅晶体。其中属于离子晶体的是 ,属于分子晶体的是 ,属于原子晶体的是____。
(2)有下列分子:HCN、P4、SO3、PCl3、BF3,其中属于非极性分子的是 。
(3)有下列离子:SO32-、SO42-、CO32-,其中VSEPR模型为正四面体形的是 ,中心原子的杂化轨道类型属于sp2杂化的是 。
(4)CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为______;与每一个钙离子距离最近并且距离相等的钙离子有____个 ;CaO晶体和NaCl晶体的晶格能分别为:CaO:3 401 kJ/mol、NaCl:786 kJ/mol。导致两者晶格能差异的主要原因_______________。
按要求回答下列问题:
(1)硫酸铜水溶液中含有的水合铜离子化学式为________。向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液,生成深蓝色的配合离子化学式为________,再向反应后的溶液中加入乙醇,析出的深蓝色晶体的化学式为________。
(2)试比较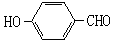 和
和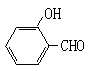 的沸点高低并说明理由_________。
的沸点高低并说明理由_________。