工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) ="v" (CrO42—) c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
( 4 ) 第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+ (aq)+3OH—(aq)
Cr3+ (aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为 。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有 。
将a mol Na2O2与b mol NaHCO3混合共热到300℃,充分反应后(不与外界物质发生反应)得到固体和气体的成分,随着a与b的比值不同而不同,当a与b的比值为下列数值时,把得到的固体和气体的化学式填入下表:
| a/b |
固体物质的成分 |
气体物质的成分 |
| <1/2 |
||
| =1/2 |
||
| =1/1 |
||
| >1/1 |
现有甲、乙两瓶无色溶液,已知它们可能是NaOH溶液和AlCL3溶液。现做如下实验:
①440mL甲溶液与120mL乙溶液反应,产生1.56沉淀
②120mL甲溶液与440mL乙溶液反应,产生1.56沉淀
③120mL甲溶液与400mL乙溶液反应,产生3.12沉淀
通过必要的计算和推理判定:
甲溶液是_______,其浓度为____mol/L。乙溶液是_______其浓度为____mol/L
已知B、C为用途广泛的金属,H具有磁性氧化物,I是一种白色胶状沉淀,它们有如图所示的转化关系(部分产物未列出):
回答下列问题:
1.E和G的化学式分别为
2.写出反应的化学方程式:
①③
写出反应的离子方程式
②④
某同学在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,由于腐蚀,其标签已破损(如图:标签上部的化学式和下部的名称都不完整),根据前几天做过的实验判断,它是中学化学中常见的溶液。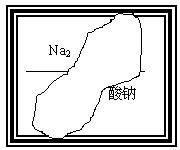
请根据已掌握的知识,对该试剂可能是什么物质的溶液作出猜想,并设计最简单的实验进行验证。
(1)下列物质中()有可能是这瓶溶液的溶质
A氯酸钠 B磷酸二氢钠 C硝酸钠 D硫酸钠
(2)请将你的所有可能的推测,并取溶液少许加入一种试剂进行验证,把实验操作、现象和结论填在下表中(不一定填满):
| 推测(写化学式) |
依据的实验操作(加入验证试剂)、现象和结论 |
| 例: Na2SiO3 |
加入盐酸,若只有白色沉淀生成者为硅酸钠溶液 |
| ①: |
|
| ②: |
|
| ③: |
|
| ④: |
现配制500mL0.5moI/L的NaOH溶液
(1)需要的仪器除用量筒、烧杯、玻璃棒外,(2)还需要的玻璃仪器有__________.
(3)用托盘天平称量氢氧化钠固体时,(4)应在小烧杯里应称量___克氢氧化钠.
(5)配制过程主要有:溶解、_____、转移、______、加水稀释、定容、摇匀,而
(6)后转移到试剂瓶里并贴上标(7)签。(8)若取上述溶液100mL,(9)其物质的量浓度为________(10)如果其它各项操作均正常,(11)仅有一项下列操作时,(12)对配制结果有何影响(填偏高、偏低、无影响或无法确定)?定容时俯视刻度线________.配制前容量瓶不干燥_______.定容后摇匀时有液体贱出______.