某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
①量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液。
②用标准液滴定至终点,记录滴定管液面读数,所得数据如下表:
| 滴定次数 |
盐酸 体积 体积 |
NaOH溶液体积读数(mL) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.00 |
18.10 |
| 2 |
20.00 |
0.00 |
16.30 |
| 3 |
20.00 |
0.00 |
16.22 |
请回答下列问题:
(1)步骤①中,量取20.00mL待测液应使用________________(填仪器名称),若在锥形瓶装液前残留少量蒸馏水,将使测定结果_______________(填“偏大”、“偏小”或“无影响”)。
(2)步骤②中,滴定时眼睛应注视________________(填仪器名称),判断到达滴定终点的依据是___________________________________________。
(3)第一次滴定记录的NaOH溶液的体积明显多于后两次的体积,其可能的原因是_______________________(填字母)
A.滴定前滴定管尖嘴有气泡,滴定结束时无气泡
B.锥形瓶装液前用待测液润洗
C.NaOH标准液保存时间过长,有部分Na2CO3生成
D.滴定终点时,俯视读数
(4)根据上表记录数据,通过计算可得该盐酸的浓度为______ mol·L-1 。
电石(主要成分为CaC2,杂质为CaO和CaS)是工业制乙炔的常见原料,某研究性学习小组拟用以下两种方案测定CaC2的质量分数,试完成下列各题。
方法一:称取1.40 g样品于圆底烧瓶中,用分液漏斗加入适量的水,使样品反应完全,将产生的无色
气体经B洗气后,通过量气装置测得乙炔气体体积为标准状况下448 mL(不考虑乙炔在水中的溶解,
下同)。
(1)电石水解生成乙炔气体的化学方程式为:
(2)用两个装入适当试剂的广口瓶、两个双孔橡胶塞及导管若干,完成上述实验的装置,请在图中将其补充完整,并注明广口瓶中装入试剂的名称。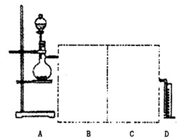
(3)对获得准确的气体体积无益的操作有(填序号)
①检查装置的气密性;
②恢复到室温后再上下调整量筒位置,使C、D两液面相平;
③在A装置胶塞上再连接一个导管,通入N2将A中C2H2全部进入到B、C中;
④读数时视线与量筒内凹液面最低点相平
(4)由以上数据可计算出样品中CaC2的质量分数为____。
方法二:称取l.40g样品于下图所示石英管中(夹持及加热装置省略),从a处不断缓缓通入空气,高
温灼烧石英管中的样品至反应完全,测得丙溶液的质量比反应前增重了1.80g,反应方程式为:2CaC2+
5O2=2CaO+ 4CO2。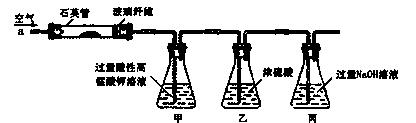
(5)反应完成后,石英管内样品易与管壁产生腐蚀,试用化学方程式解释其原因
(6)甲锥形瓶中酸性高锰酸钾溶液的作用为
(7)由此方法测得的样品中CaC2的质量分数比方法一中的____(填“大”、“小”或“相
等”),从实验装置的角度看,原因为。
某同学在学习硝酸与硫酸时,对两种酸与铜的反应情况进行研究,试完成下列各题。
(1)在甲、乙两个烧杯中,分别装入40mL浓度均为2mol·L-1的稀硫酸和稀硝酸,并向其中各加入 4g束状铜丝,观察现象,试完成下列实验报告: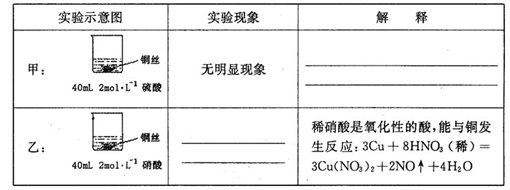
(2)充分反应后,将甲、乙烧杯混合,再使之充分反应,最终所得溶液溶质为____,剩余固体总质量为g
(3)若甲中硫酸溶液体积V(V>40mL)可变,其余数据不变,则:
①当甲、乙烧杯混合充分反应后,溶液中只有一种溶质时,V=____mL,若要将溶液中的Cu2+沉淀完全,应加NaOH使溶液的pH至少为____。已知KsP[Cu(OH)2]=2.2×l0-20,1g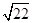 =0.7)
=0.7)
②能否通过硫酸溶液体积的改变,使铜丝在甲、乙烧杯混合充分反应后完全溶解? 试写出推理过程________。
工业生产纯械的工艺流程示意图如下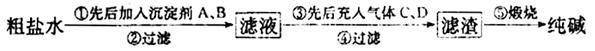
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(A来源于石灰窑厂),则B的化学式_________。
(2)②过滤后滤液中要通入C和D气体,则先通入的C气体是_________(填化学式),原因是_________。
(3)通入C和D气体后发生反应的化学方程式是_________。
(4)④过滤后,向滤液中通氨气,加入细小食盐颗粒,析出副产品________ (填写化学式),通氨气与加入细小食盐颗粒的作用是_________。
(5)写出⑤锻烧发生反应的化学方程式_________。产品纯碱中含有碳酸氢钠,若用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质童分数ω(NaHCO3)= _________ (注明表达式中所用的有关符号的含义)。
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2 • 2H2O)。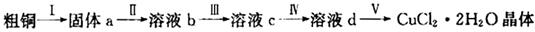
(1)为了完成步骤I,可采用如下图所示的装置将粗铜转化为固体a。
在该实验中,加热A、C装置中的酒精灯时,应该先点燃_______装置的酒精灯,D装置的作用是
_______,C装置中生成的产物是_______。
(2)步骤II中的操作是:将步骤I中的固体加入到容器中,然后加入_______,固体完全溶解。
(3)步骤III中加入的试剂是H2O2,其目的是提高最终制备的氯化铜晶体的纯度,试写出有关反应的离子方程式______________。
(4) 步骤IV中应先加入某试剂,然后过滤得到滤液。为了调节溶液的pH只使Fe3+完全沉淀,加入的试剂是CuO粉末而不用氨水或NaOH溶液,其理由是_______。
(5)步骤V中,将溶液蒸发浓缩、冷却结晶、过滤得到CuCl2·2H2O晶体。现欲得到无水CuCl2,在实验室也可以采用上述装置完成CuCl2 • 2H2O脱水得到无水CuCl2,则A装置中的两种化学试剂是_____。
某Na2CO3样品中混有一定量的Na2SO4 (设均不含结晶水),某化学兴趣小组采用两种方案测定该样品中Na2CO3的质量分数,试回答下列问题。
方案一:利用下列方案完成Na2CO3质量分数的測定
(1)操作③和④的名称分别为_______。
(2)上述操作①~④中,使用到玻璃棒的有______(填操作序号)。
(3)判断操作②否完成的方法是______
方案二:采用下图实验装置(夹持仪器已省略).选用下列试剂: a.浓硫酸b.饱和NaHCO3溶液C.6mol/L盐酸D.2mol/L硫酸, e.碱石灰f. 无水CaCl2,測定样品中Na2CO3,的质量分数:
(4)填写表中空格:
| 仪器 |
试剂 |
加入该试剂的目的 |
| A |
鼓入空气时洗去CO2 |
|
| B |
使样品充分反应放出气体 |
|
| C |
a |
|
| D |
e |
充分吸收CO2 |
| E |
e |