海水中蕴藏着丰富的资源,海水综合利用的流程图如下。
(1)用NaC1做原料可以得到多种产品。
①工业上由NaC1制备58.5kg金属钠时,可生成标准状况下的氯气 L。
②实验室用惰性电极电解氯化钠稀溶液可制备“84消毒液”,通电时产生的氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式 。
(2)分离出粗盐后的卤水中蕴含丰富的镁资源,经转化后可获得MgC12粗产品。租产品的溶液中含有的Fe3+、Fe2+、Mn2+转化为沉淀除去;Fe(OH)3呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表)。
若只加入题(1)中得到的一种产品即可达到上述除杂目的,则该产品的化学式为 ,最终控制溶液的pH值为 。MgC12粗产品在精制净化后,熔融、电解可得镁单质。环境专家认为可以用金属镁将水体中的NO3—还原为N2,从而消除污染。请补充完整以下离子方程式并配平:
NO3—+ Mg+ H2O= N2↑+ Mg(OH)2+
(3)碘在地壳中主要以NaIO3形式存在,在海水中主要以,I—的形式存在。几种粒子之间有如下转化关系: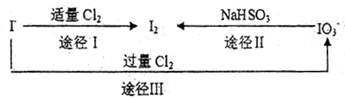
①如以途径I制取I2,加的、C12要适量;如过量就会发生途径Ⅲ的副反应,在该副反应产物中,IO3—。与C1—物质的量之比1:6,则氧化剂剂还原剂物质的量之比为 。
②如以途径Ⅱ在溶液中制I2,反应后溶液显酸性,则反应的离子方程式是 。
A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素。在一定条件下相互转化关系如下图所示(部分产物已略去)。请按要求回答下列问题: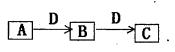
(1)若B、C为氧化物,B转化为C时,质量增加25%,C能够与水反应生成一种强酸,则B转化为C的化学方程式是:。
(2)若D为某金属单质,向C的溶液中滴加硝酸银溶 液,产生不溶于稀硝酸的白色沉淀,则B的化学式是。
液,产生不溶于稀硝酸的白色沉淀,则B的化学式是。
(3)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,则A和C反应的离子方程式是:。
符合条件的D物质可能是(填序号):
①硫酸②醋酸⑨氢氧化钠④一水合氨⑤氯化钡
某研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):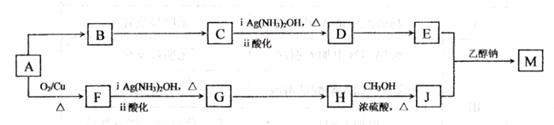
已知:①的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同环境的氢原子,其个数比为3:1。
②ROOCCH2COO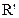 +CH2=CHCOO
+CH2=CHCOO
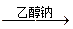
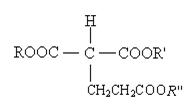
(R、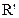 、
、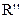 代表相同或不相同的烃基)
代表相同或不相同的烃基)
(1)A分子中的含氧官能团的名称是______________________。
(2)D→E反应的化学方程式是____________________。
(3)A→B反应所需的试剂是_______________。
(4)G→H反应的化学方程式是____________。
(5)已知1mol E与2 mol J反应生成1 mol M,则M的结构简式是__ _________。
_________。
(6)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有_____种,其中任意1种的结构简式是___________。
(7)J可合成高分子化合物,该高分子化合物结构简式是_________ __。
__。
有关FeSO4的转化关系如下图所示(无关物质已略去)。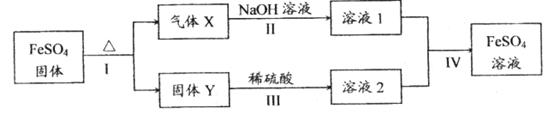
已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀。
②Y是红综色的化合物。
(1)气体X的成分是(填化学式)_____________。
(2)反应I的反应类型属于(填序号)______________。
a. 分解反应 b. 复分解反应 c. 置换反应 d. 化合反应 e. 氧化还原反应
(3)溶液2中金属阳离子的检验方法是_______________。
(4)若经反应I得到16g固体Y,产生的气体X恰好被0.4L 1mol/L NaOH溶液完全吸收,则反应Ⅳ中生成FeSO4的离子方程式是__________ __。
__。
现有3种化合物 A、B、C均含短周期元素R,其转化关系如下图所示。
A、B、C均含短周期元素R,其转化关系如下图所示。
(1)若A由第三周期2种元素组成。常温下,0.1mol/L X溶液的pH=13,则R在周期中的位置是______________。X中阴离子的电子式是_________,B转化为C的离子方程式是___________。
(2)若常温下A、B、C、X均为气态物质,1mol A中含有共价键的数目约为1.806×1024,X为单质,A与X反应生成B的化学方程式是_____________;在一定条件下,A可与C反应消除C对大气的污染,该反应的化学方程式是________________。
书写下列化学反应方程式
(1)NO2与水反应
(2)C与浓硫酸反应
(3)Mg与CO2反应