2—甲基—2—丁烯酸甲酯是一种重要的化工原料。下面是该物质的一种合成路线: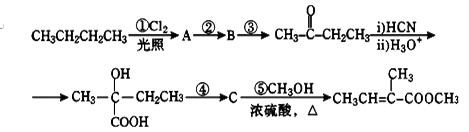
已知:R-CN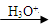 R-COOH。请回答下列问题:
R-COOH。请回答下列问题:
(1)A是一氯代烷,则其结构简式为_____________,反应②的反应条件是_____________;
(2)写出反应③的化学方程式:__________________________________________。
(3)C的结构简式为______________,其所含官能团的名称是________________。
(4)步骤④的反应类型是______________。
(5)2—甲基—2—丁烯酸甲酯的某种羧酸类链状同分异构体X,分子中含有3个甲基。则X的结构简式为 。
在一定条件下可实现如图所示物质之间的相互转变:
(1)根据你的推测,请填写下列物质的化学式:
A:______;B:______,D:______;G:______,
(2)简要说明A可转变为B和C的原因,写出有关反应的化学方程式:
___________________________________________________
(3)写出E气体与A溶液反应的离子反应方程式:______
一种由电石为原料合成的烃,其化学式为C4H4,它是合成一种橡胶的中间体,它有多种同分异构体。
请回答:
(1)它的一种链式结构的同分异构体的结构简式是______。
(2)它的一种同分异构体,每个碳均达饱和,且构成的空间构型中碳与碳间的夹角都相同,该结构中碳与碳间的键角应是________。
A、B都是芳香族化合物,1molA水解得到1molB和1mol醋酸。A、B的分子量都不超过200,完全燃烧都只生成CO2和H2O。且B分子中碳和氢元素总的质量百分含量为65.2%(即质量分数为0.652)。A溶液具有酸性,不能使FeCl3;溶液显色。
(1)A、B分子量之差为______。
(2)1个B分子中应该有_______个氧原子。
(3)A的分子式是________。
(4)B可能的三种结构简式是______、______、_______。
一卤代烃Rx与金属钠作用,可以增加碳链制高级烃,反应的化学方程式为Rx+2Na+R′x→R—R′+2Nax,其中x表示卤原子,R和R′为烃基,可相同也可不同,试以苯、乙炔、Br2、HBr销为主要原料,通过三步反应制取 CH=CH2,其制取的化学方程式为(1)_______,(2)______,(3)_______。
CH=CH2,其制取的化学方程式为(1)_______,(2)______,(3)_______。
有50mL氢气和氯气的混合气体,经光照发生爆炸反应后恢复到原来的温度和压强,发现体积仍是50mL.试回答:
(1)若H2反应完全而Cl2有剩余,用实验进行验证的方法是;
(2)若H2与Cl2恰好完全反应,用实验进行验证的方法是.