中学常见的某反应的化学方程式为A+B→C+D+H2O(未配平,反应条件略去)。请回答下列有关问题:
(1)若A是铁,B是稀硝酸(过量),且A可溶于C溶液中。则A与C反应的离子方程式为_________________________________________________________________。
(2)若C、D均为气体,且都能使澄清石灰水变浑浊,则上述反应的化学方程式为___________________________________________________________________________。
(3)若C是无色刺激性气味的气体,其水溶液呈弱碱性。C能发生催化氧化反应,写出该反应的化学方程式____________________________________________________。
(4)若D为氯碱工业的主要原料,C是造成温室效应的主要气体之一,则上述反应的化学方程式为_____________________________________________________。
(1)汽车发动机工作时会引发N2和O2反应,生成NOx等污染大气.其中生成NO的能量变化示意图如右图:
①该反应的热化学方程式为.
②根据下图所示,只改变条件R,当N2的转化率从a3到a1时,平衡常数K.
| A.可能增大 |
| B.一定不变 |
| C.可能不变 |
| D.可能减小 |
E.增大、减小、不变均有可能
(2)尿素(又称碳酰胺)是含氮量最高的氮肥,工业上利用CO2和NH3在一定条件下合成尿素的反应分为:
第一步:2NH3(g)+CO2(g) H2NCOONH4(氨基甲酸铵) (l)
H2NCOONH4(氨基甲酸铵) (l)
第二步:H2NCOONH4(l) H2O(g)+H2NCONH2(l)
H2O(g)+H2NCONH2(l)
某实验小组模拟工业上合成尿素的条件,在一体积为500 L的密闭容器中投入4 mol氨和1 mol二氧化碳,验测得反应中各组分的物质的量随时间的变化如图所示:
①合成尿素总反应的快慢由第步反应决定.
②反应进行到10 min时测得 CO2 的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)=mol/(L·min).
③由氨基甲酸铵和CO2曲线变化可得出关于浓度变化和平衡状态的两条结论是:
a.;
b..
依据有关信息解答下列化学实验问题:
(Ⅰ)醛类是重要的工业原料,可以跟亚硫酸氢钠饱和溶液发生加成反应,生成是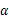 -羟基磺酸钠(易溶于水,不溶于饱和亚硫酸氢钠溶液)
-羟基磺酸钠(易溶于水,不溶于饱和亚硫酸氢钠溶液)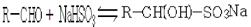
(1)若使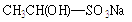 全部变成乙醛,可采用的试剂是或。
全部变成乙醛,可采用的试剂是或。
(Ⅱ)实验室利用苯甲醛(安息香醛)制备苯甲醇和苯甲酸的化学原理: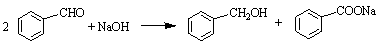
已知部分物质的性质:
苯甲醇:稍溶于水,易溶于有机溶剂;苯甲醛:微溶于水,易溶于有机溶剂;
苯甲酸:溶解度为0.34g,易溶于有机溶剂。
主要过程如图所示: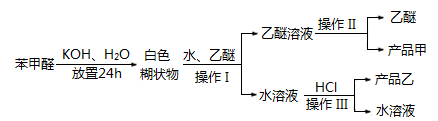
回答下列问题:
(2)操作I的名称是______,乙醚溶液中所溶解的主要成分是____;
(3)操作Ⅲ的名称是______,产品乙是______。
(4)按上述操作所得的产品甲中常含有一定量的有机杂质(填写杂质的名称),限用下列试剂:酸性KMnO4、稀NaOH溶液、稀H2SO4、饱和NaHSO3溶液。写出检验甲中含有该杂质的过程:。
回收利用炼铜工业产生的排放物,既能节约资源,又能保护环境。
(1)用氨水吸收尾气中的SO2后,再加入硫酸,可获得SO2
和(NH4)2SO4两种产品。相关反应的化学方程式为________、________。
(2)烟灰中金属元素以硫酸盐和氧化物形态存在,其中锌、铅的含量最大,其次为铜、铁等。烟灰的回收利用工艺如下:
①“沉铜”可得到单质铜,该步骤应加入的试剂是________。
②“一次浸取”铜浸出率较低,原因是烟灰中部分铜元素以________(填化学式)残留在浸出渣中,“二次浸取”应选择_________(填化学式)作浸取剂。
(3)从贵金属阳极泥中可提取粗银。电解法精炼粗银时采用AgNO3和HNO3的混合液作电解液,阴极的主要电极反应式为________。阴极还有少量副反应发生,产生的气体遇空气迅速变为红棕色,该副反应的电极反应式为________。
已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应
Ⅰ:WO42-(aq) + Ca(OH)2(s)  CaWO4(s) + 2OH-(aq)。
CaWO4(s) + 2OH-(aq)。
(1)下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。
①计算T1时KSP(CaWO4)= ________。
②T1________ T2(填“>”“=”或“<”)。
(2)反应Ⅰ的平衡常数K理论值如下表:
| 温度/℃ |
25 |
50 |
90 |
100 |
| K |
79.96 |
208.06 |
222.88 |
258.05 |
①该反应平衡常数K的表达式为________。
②该反应的△H________0(填“>”“=”或“<”)。
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4) =" c(NaOH)" =" 0.5" mol·L-1]中,加入过量Ca(OH)2,反应达到平衡后WO42—的沉淀率为60%,计算实验测得的平衡常数。
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,分析其作用:________。
【化学——选修2:化学与技术】
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术通常包括煤的气化技术和液化技术。其中煤的液化技术又可以分为_____和______;
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示: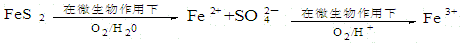
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为___________;第二步反应的离子方程式为____________。
(3)工业煤干馏得到的产品有焦炭、___________、___________等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:_______;
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:______________;
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是;
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。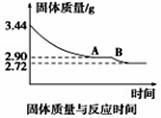
①石膏的化学式为_____________;
②图像中AB段对应化合物的化学式为_______________。