如图甲、乙是电化学实验装置。
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为_________________________________________;
②乙中总反应的离子方程式为___________________________________________;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为_______________________________________________________。
(2)若甲 、乙两烧杯中均盛有CuSO4溶液。
、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为___________________________________________;
②如果起始时乙中盛有200mLpH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入______________(填写物质的化学式)_______________g。
A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
|
①A和E的溶液显碱性,0.1mol·L-1A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。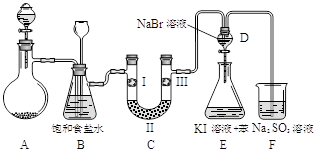
⑴制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:
__________________________________________________________________。
⑵装置B中饱和食盐水的作用是_______________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象______________________________。
⑶装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入_______。
| a |
b |
c |
d |
|
| I |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| II |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| III |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
⑷设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为______色,说明氯的非金属性大于溴。
⑸打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是_____________。
⑹有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:
______________________,判断改用NaHSO3溶液是否可行______(填“是”或“否”)。
(16分)某学习小组以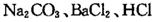 溶液作试剂,设计提纯含有少量
溶液作试剂,设计提纯含有少量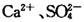 的粗盐。其实验方案如下:
的粗盐。其实验方案如下: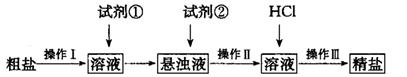
(1) 操作I的名称为________;试剂①应选用_______;检验试剂②是否过量的方法______。
(2) 操作I〜III共用到玻璃棒________次;从悬浊液到精盐的实验过程中,某同学未按上述方案进行,最终导致精盐纯度偏低。其做法可能是________________。
(3)测定产品精盐中NaCl的含量的实验步骤是:
第一步:准确称取a g干燥精盐于锥形瓶中,加人30. OmL蒸馏水。
第二步:向上述锥形瓶中加人几滴突光素指示剂。
第三步:用浓度为的AgNO3标液滴至终点(溶液呈浅红色),消耗AgNO3溶液V mL。
①盛装干燥精盐的烧杯应放在________中保存(填仪器名称);
②终点时溶液呈浅红色是荧光素指示剂与________反应(填“Ag+”或"NO3-”);
③某同学在第二次滴定时,滴定前,后管内液面分别如图,则其所得V=________mL;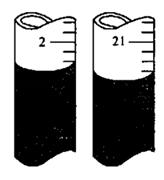
④NaCl的质量分数为________ (用字母表示)
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有;
(2)硫酸铜溶液可以加快氢气生成速率的原因是;
(3)实验室中现有
、
、
、
等4种溶液,可与实验中
溶液起相似作用的是;
(4)要加快上述实验中气体产生的速率,还可采取的措施有(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量
粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
||||||
| 4 | 30 |
1 |
2 |
3 |
4 |
5 |
| 饱和 溶液/ | 0 |
0.5 |
2.5 |
5 |
6 |
20 |
|
7 |
8 |
9 |
10 |
10 |
0 |
①请完成此实验设计,其中:
1=,
6=,
9=;
②反应一段时间后,实验
中的金属呈色,实验E中的金属呈色;
③该同学最后得出的结论为:当加入少量
溶液时,生成氢气的速率会大大提高。但当加入的
溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因。
淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去):
实验过程如下:
① 将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30 min,然后逐渐将温度降至60℃左右;
② 将一定量的淀粉水解液加入三颈烧瓶中;
③ 控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④ 反应3h左右,冷却,减压过滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的目的是:。
(2)冷凝水的进口是(填a或b);实验中若混酸滴加过快,将导致草酸产量下降,其原因是。
(3)检验淀粉是否水解完全所用的试剂为。
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有。
(5)当尾气中n(NO2):n(NO)=1:1时,过量的NaOH溶液能将NOx全部吸收,发生的化学反应为:NO2+NO+2NaOH=2NaNO2+H2O,若用含硫酸的母液来吸收氮氧化物,其优点是、缺点是。
(6)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2↑+ 8H2O
称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色由变为。滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为。