某研究性学习小组将下列装置如图连接,a、b、c、d、g 、h都是惰性电极。A中盛有100mlCuSO4溶液;B中盛有100g质量分数为16%的氢氧化钠溶液;将电源接通后,在g极附近显红色。
、h都是惰性电极。A中盛有100mlCuSO4溶液;B中盛有100g质量分数为16%的氢氧化钠溶液;将电源接通后,在g极附近显红色。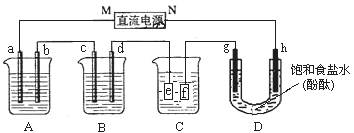
试回答下列问题:
(1)电源M极的名称是______。
(2)通电一段时间,取出电极,向A中加入4.9gCu(OH)2,溶液与电解前相同,则电解时电路中通过的电子为_________mol,原CuSO4溶液物质的量浓度为________mol•L-1;
(3)B中d的电极反应式为________________________________________________,
d极上产生的气体体积为____________L(标况)
(4)欲用C装置给铜镀银,f是__________(填银或铜),电镀液是__________溶液。
(5)电解后将D中溶液倒入烧杯,稀释至200ml,此时溶液的PH=_______。
金属镁在氮气中燃烧生成Mg3N2,它与水反应生成NH3和Mg(OH)2。请回答以下问题:
(1)Mg3N2的电子式可表示为____________________,由________键组成。
(2)Mg3N2与盐酸反应生成_______种盐,分别为_______________________________。
(3)NH4Cl的电子式为______________________,NH5的电子式为_________________。
(4)r(N3—)________r(Mg2+)(填“>”、“=”或“<”)=
有A、B、C、D四种元素,A的+2价离子与氩原子的电子结构相同,B原子有三个电子层,其单质为双原子分子。C的核外电子比A少一个,D与B同周期,其单质为淡黄色固体。
(1)写出A、B、C、D的离子符号:______________________。
(2)A、B、C、D的离子半径由小到大的顺序是:____________________________。
(3)写出A与B、C与D形成的化合物的电子式_________________________。
A+、B+、C—、D、E五种微粒(分子或离子),它们都分别含有10个电子,已知它们有如下转化关系:
①A++C—→D+E↑②B++C—→2D
(1)写出①的离子方程式:________________________________。
写出②的离子方程式:________________________________。
(2)除D、E外,请再写出两种含10个电子的分子:___________________。
(3)除A+、B+外,请再写出两种含10个电子的阳离子:_________________。
1~18号元素中三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外层上的电子数是Y和Z两元素原子最外层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请回答:
(1)X元素的名称是________,Y元素的名称是_______,Z元素的名称是________。
(2)化合物XZ3化学式是________。
(3)分别写出X、Y的含氧酸的化学式:______________________________________。
A、B、C、D、E五种元素,已知:
①A原子最外层电子数是次外层电子数的两倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同,E原子M层上的电子比K层上的多5个。
②常温下B2是气体,它对氢气的相对密度是16。
③C的单质在B2中燃烧,生成淡黄色固体F,F与AB2反应可生成B2。
④D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体DB2,D在DB2中的含量为50%。根据以上情况回答:
(1)A_______、B_______、C_______、D_______、E_______。(写元素符号)
(2)E的原子结构示意图_______________,C的离子结构示意图________________。
(3)F和AB2反应的化学方程式_________________________________。