水是生命之源。饮用水消毒作为控制水质的一个重要环节,液氯消毒是最早的饮用水消毒方法。近年来科学家提出,氯气能与水中的有机物发生反应,生成的有机氯化物可能对人体有害。二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)氯气溶于水能杀菌消毒的原因是 。
(2)在ClO2的制备方法中,有下列两种制备方法:
方法一:NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:C6H12O6+24NaClO3+12H2SO4=24ClO2↑+6CO2↑+18H2O+12Na2SO4
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
(3)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水ClO2-的含量应不超过0.2 mg·L-1。
饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示。当pH≤2.0时,ClO2-也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI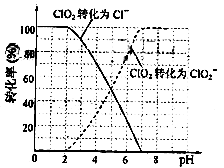
①请写出pH≤2.0时,ClO2-与I-反应的离子方程式 。
②配制Na2S2O3标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的 (填字母代号)。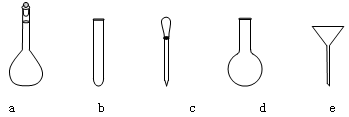
③请完成相应的实验步骤:
步骤1:准确量取VmL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0
步骤3:加入足量的KI晶体。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5:调节溶液的pH≤2.0。
步骤6;再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
④滴定终点的现象是 。
⑤根据上述分析数据,测得该引用水样中的ClO2-的浓度为 mg·L-1(用含字母的代数式表示)。
(4)判断下列操作对ClO2-的浓度测定结果的影响(填“偏高”、“偏低”或“无影响”)
① 若在配制标准溶液过程中,烧杯中的Na2S2O3溶液有少量溅出,使测定结果 。
② 若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果 。
选做【化学—化学与技术】海水是宝贵的自然资源,利用海水水可以得到一系列产品,也可以进行废气处理。
(1)利用氯碱工业产品处理含SO2的烟气的流程如下:
①氯碱工业反应的离子方程式是 。
②上述流程中循环利用的物质是 。
(2)利用海水脱硫可以有效地解决煤燃烧排放的SO2造成的一系列环境问题。其工艺流程如图所示: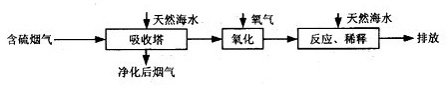
天然海水吸收含硫的烟气后.需要用氧气进行氧化处理,其反应原理的化学方程式是 ;氧化后的海水需要加入氢氰化钠.与之混合后才能排放,该操作的主要目的是 。
(3)从海水中捉纯粗盐后的母液中含有K+、Na+、Mg2+等阳离子,对母液进行一系列的加工可制得金属镁。
①在母液中加入石灰乳反应的离子方程式为 。
②要利用MgCl2·6H2O制得无水氯化镁,应采取的措施是 。
③电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为同体镁,下列物质中可以用作镁蒸气的冷却剂的是 (填字母)。
| A.Ar |
| B.CO2 |
| C.空气 |
| D.O2 |
E.水蒸气
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知:2CO(g)+ O2(g)=2CO2(g),ΔH=-566 kJ·mol-1
2Fe(s)+  O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
则CO还原Fe2O3反应的热化学方程式为: 。
Ⅱ.反应  Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
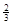 Fe(s)+ CO2(g)在1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
Fe(s)+ CO2(g)在1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
(1)反应到10min时,用CO2表示该反应的速率为 ,CO的平衡转化率=____________,平衡后再分别加入Fe、Fe2O3、CO、CO2各0.4mol,则正反应速率 逆反应速率(填“大于”、“小于”或“等于”)。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________.
a.降低反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+2H2(g) CH3OH(g),请根据图示回答下列问题:
CH3OH(g),请根据图示回答下列问题: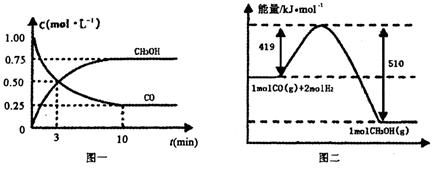
(1)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 |
反应物投入的量 |
反应物的 转化率 |
CH3OH的浓度 |
能量变化 (Q1、Q2、Q3均大于0) |
| 甲 |
1molCO和2molH2 |
α1 |
c1 |
放出Q1kJ热量 |
| 乙 |
1molCH3OH |
α2 |
c2 |
吸收Q2kJ热量 |
| 丙 |
2molCO和4molH2 |
α3 |
c3 |
放出Q3kJ热量 |
则下列关系正确的是________.
A.c1=c2
B.2Q1=Q3
C.2a1=a3
D.a1+a2=1
E.该反应若生成1molCH3OH,则放出(Q1+Q2)kJ热量
(2)若在一体积可变的密闭容器中充入lmolCO、2molH2和1molCH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动。
(3)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式______________________,若电解质溶液为酸性,写出正极反应式_________________。
(选做题】本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.【物质结构与性质】前四周期元素A、B、C、D、E原子序数依次增大,A是周期表所有原子中原子半径最小的,B有三个能级,且各个能级上电子数相等;D基态原子有两个电子层,且p轨道电子与s轨道电子的相等;E有4个电子层,且与A最外层电子数相同,其他各层均排满。
(1)写出E原子的基态核外电子排布式 。
(2)A、C和D可以形成很多物质,其中A2CD的分子B原子的杂化方式为 ;
1molA2CD分子中含有σ键数目为 。
(3)B与D形成的酸根离子BD32-
①BD32-的空间构型为 (用文字描述)。
②写出一种与BD32-互为等电子体的分子的化学式 。
(4)E晶胞结构如图所示,该晶体中每个E原子周围距离最近的E原子数目为 。
SCR是一种烟气脱硝技术(除去烟气中的NOx),其流程如下: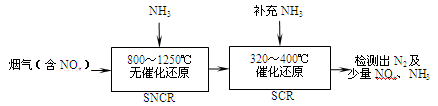
(1)反应2NO+2CO 2CO2+N2的平衡常数表达式为 。
2CO2+N2的平衡常数表达式为 。
(2)SCR流程中发生的主要反应有:
4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g)ΔH=-1627.2kJ•mol-1;
4N2(g)+6H2O(g)ΔH=-1627.2kJ•mol-1;
6NO(g)+4NH3(g) 5N2(g)+6H2O(g)ΔH=-1807.0 kJ•mol-1;
5N2(g)+6H2O(g)ΔH=-1807.0 kJ•mol-1;
6NO2(g)+8NH3(g) 7N2(g)+12H2O(g)ΔH=-2659.9 kJ•mol-1;
7N2(g)+12H2O(g)ΔH=-2659.9 kJ•mol-1;
反应N2(g)+O2(g) 2NO(g)的ΔH= kJ•mol-1。
2NO(g)的ΔH= kJ•mol-1。
(3)NO和NH3在Ag2O催化剂表面的反应活性随温度的变化曲线见下图。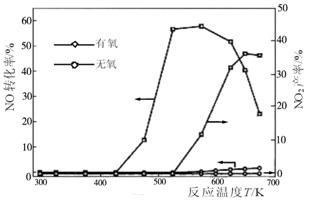
①由图可以看出,脱硝工艺流程应在 (填“有氧”或“无氧”)条件下进行。
②随着反应温度的进一步升高,在有氧的条件下NO的转化率明显下降的可能原因是 。
(4)NO也可用尿素[CO(NH2)2]还原,写出尿素与NO反应的化学方程式: 。
(5)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图: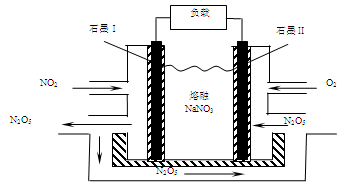
写出石墨Ⅱ发生的电极反应为 。若生成1molN2O5,则理论上需要消耗标准状况下O2的体积为 L。
铜工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
(1)金属M为 ,操作1中需要的主要玻璃仪器是玻璃棒、______、______。
(2)加入新制氯水的的作用是(用离子方程式表示) __________ 。滤渣D的主要成分是 (填化学式)。
(3)充分焙烧的化学方程式为 。如下图所示,焙烧操作中的一处错误是_________。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。则操作2中得到固体C的实验操作是:蒸发浓缩、 ,洗涤、干燥。90℃时Ksp(Li2CO3)的值为 。
| 温度/℃ |
10 |
30 |
60 |
90 |
| 浓度/mol・L-1 |
0.21 |
0.17 |
0.14 |
0.10 |