(13分)(1)过氧化钠可用作于制氧剂,写出过氧化钠与二氧化碳反应的化学方程式
(2)工业上制取漂白粉的化学方程式为______________ ______。
(3)在标准状况下,33.6 L氯气的质量是________g,将红热的铁丝与其完全反应,反应的化学方程式为 ,最多可消耗铁的物质的量为 mol。
28.(6分,每空2分)已知丙烯与氯化氢的反应原理如下:
主反应:CH2=CHCH3 + HCl → CH3CHClCH3(主要产物);
副反应:CH2=CHCH3 + HCl → CH2ClCH2CH3(副产物) A
A
A;B;C;
(6分,每空1分)已知乙烯发生如下变化:
(1)分别写出B的名称和有机物C 的名称
(2)写出反应①的化学方程式该反应的类型是
(3)写出反应②的化学方程式 该反应的类型是
该反应的类型是
(3分,每空1分)人们对苯及芳香烃的认识有一个不断深化的过程。
(1)已知分子式为 C6H6 的结构 有多种,其中的两种为
有多种,其中的两种为
1 mol C6H6 与H2加成时:Ⅰ需______mol,而Ⅱ需 _______mol。
(2)今发现 C6H6还可能有另一种如上图立体结构:该结构的二氯代物有_______种。
(6分,每空1分)下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合(氢原子省略)。回答下列问题: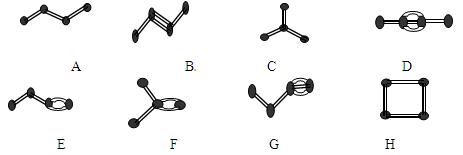
(1)图中属于链状烷烃的是(填编号)
(2)写出上图中B、C的结构简式 B、C
(3)与A互为同分异构体的 是(填编号)
是(填编号)
(4)用系统命名法对下列烷烃进行命名:
①(CH3)2CHC(C2H5)2C(CH3)2C2H5②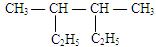
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。T℃时反应2SO2(g)+O2(g) 2SO3(g)过程中的能量变化如图所示,回答下列问题。
2SO3(g)过程中的能量变化如图所示,回答下列问题。
(1)T℃时将3mol SO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol , 则达到平衡时SO2的转化率为。(1分)
SO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol , 则达到平衡时SO2的转化率为。(1分)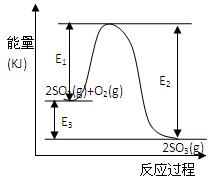
(2)下列叙述能证明该反应已达化学平衡状态的是(填序号)(2分)
①SO2的体积分数不再发生变化②容器内压强不再发生变化③容器内气体分子总数不再发生变化④相同时间内消耗2n molSO2的同时生成n molO2⑤相同时间内消耗2n molSO2的同时生成2n mol SO3
SO3
(3)反应(填“放出”或“吸收”)热量(用E1、E2或E3表示)(2分)。
(4)若以下图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应。
写出两电极的电极反应式: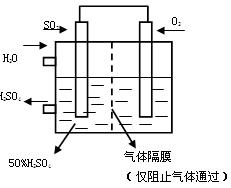
;。(2分) [来网]为稳定持续生产,硫酸溶液的浓度应维持不变,则通入S O2和水的质量比为(2分)
O2和水的质量比为(2分)