下列说法正确的是( )
| A.pH=2与pH=1的硝酸中c(H+)之比为1:10 |
| B.Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1 |
| C.0.2 mol?L-1与0.1mol/L醋酸中c (H+)之比为2:1 |
| D.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1 |
0.5 L某浓度的NaCl溶液中含有0.5 mol Na+,下列对该溶液的说法中不正确的是
| A.该溶液中溶质的物质的量浓度为1 mol·L-1 |
| B.该溶液中含有58.5 g NaCl |
| C.配制100 mL该溶液需用5.85 g NaCl(用分析天平称量) |
| D.量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1 mol |
用氢氧化钠固体配制0.10 mol/L的氢氧化钠溶液,下列说法中错误的是
| A.定容时俯视容量瓶刻度线,会造成所配溶液浓度偏大 |
| B.移液时不慎有部分液体溅出,会造成所配溶液浓度偏小 |
| C.称量时托盘上要垫上干净的称量纸 |
| D.定容摇匀后发现液面下降,不应再加蒸馏水 |
已知酸性高锰酸钾溶液可以将FeSO4氧化,反应的化学方程式为 2KMnO4+10FeSO4+8H2SO4===K2SO4+X+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是
| A.方程式中的X为2MnSO4 |
| B.氧化性:KMnO4>Fe3+>I2 |
| C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.30 mol |
| D.AB段是高锰酸钾和碘化钾溶液反应,BC段的反应为2Fe3++2I-===2Fe2++I2 |
还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
已知转化过程中的反应为
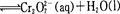
转化后所得溶液中铬元素的含量为28.6 g/L, CrO42-有10/11转化为Cr2072-,下列说法不正确的是
| A.溶液颜色保持不变,说明上述可逆反应达到平衡状态 |
| B.若用绿矾(FeS04·7H2O)作还原剂,处理1 L废水,至少需要458.7g |
| C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5 |
| D.常温下Ksp=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
下列图示与对应的叙述不相符的是
A.图甲表示反应:4CO(g)+2NO2(g) N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2 N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2 |
B.图乙表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(g)的影响,乙的压强比甲的压强大 3C(g)+D(g)的影响,乙的压强比甲的压强大 |
| C.图丙表示的反应是吸热反应,该图表明催化剂不能改变化学反应的焓变 |
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 |