下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。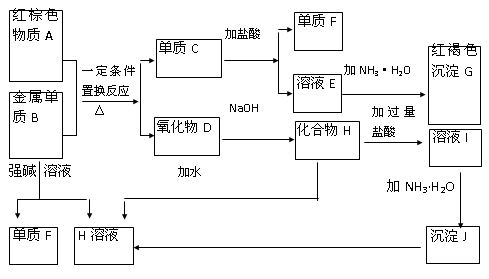
(1)单质B的化学式是 ,单质F的化学式是________ ,写出物质A的一种用途 。
(2)写出单质B与强碱溶液反 应的离子方程式 ,
应的离子方程式 ,
写出由沉淀J生成 H溶液的离子方程式 ,
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式 ,
白色沉淀L会迅速变为 色,最终变为红褐色沉淀G,写出L变为G的化学反应方程式 。
(4)溶液I中所含金属离子是_____________________。
在1—18号元素中,某元素R最外层电子数与电子层数相同,则R元素可能是(写元素符号)__________________。
微粒 核外有18个电子,则它的质子数为_________,核内中子数为_________。
核外有18个电子,则它的质子数为_________,核内中子数为_________。
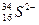 中的质子数是____________,中子数是____________,核外电子数是____________,质量数是____________。
中的质子数是____________,中子数是____________,核外电子数是____________,质量数是____________。
两种气态物质Am和Bn,已知2.4 g Am和2.1 g Bn所含的原子个数相等,而分子个数之比为2∶3,A、B两种元素的原子核中质子数与中子数相等,A原子的L层电子数是K层电子数的3倍。则:
(1)A、B分别是什么元素?
A____________,B____________。
(2)Am中的m值是______________。
今有A、B、C、D四种元素,已知A元素是自然界中含量最多的元素;B元素为金属元素,它的原子核外K、L层电子数之和等于M、N层电子数之和;C元素的单质及其化合物的焰色反应都显黄色;氢气在D元素单质中燃烧呈苍白色。
(1)试推断并写出A、B、C、D四种元素的名称和符号。
(2)写出上述元素两两化合而成的化合物的化学式。