(14分) Mg(ClO3)2常用作催熟剂、除草剂等,下图为制备少量Mg(ClO3)2·6H2O的方法: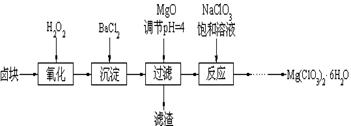
已知:1、卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
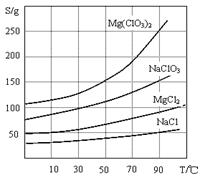
2、几种化合物的溶解度(S)随温度(T)变化曲线如上图。
(1)加入BaCl2的目的是除_________,如何判断该离子已除尽_____________________。
(2)加入NaClO3饱和溶液会发生反应:MgCl2+2NaClO3==Mg(ClO3)2+2NaCl↓,请利用该反应,结合溶解度图,制取Mg(ClO3)2·6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应;②蒸发浓缩;③ ;④冷却结晶;
⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50g产品溶解定容成100mL溶液。
步骤2:取10mL配好的溶液于锥形瓶中,加入10mL稀硫酸和20mL1.000mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/L K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:
Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
(3)写出步骤2中所发生反应的离子方程式 。
(4)步骤3中若滴定前用标准液润洗滴定管,会导致最终结果 (填“偏大”、“偏小”或“不变”)。
(5)产品中Mg(ClO3) 2·6H2O的质量分数为 (计算结果保留两位小数) 。
在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,是氧化剂;是氧化产物;
电解质是指在___________________________能够导电的_______________。
现有下列物质:①碳酸氢钠②氧化钠③SO2 ④铁⑤氧气⑥氢氧化钙⑦盐酸⑧乙醇 ⑨硫酸请将上述物质按下列要求分类,并将其序号填入空白处:
按组成分类,属于单质的是 ,属于氧化物的是 ,属于盐的是 ;属于混合物的是。(填代号)
5.4g水与____g硫酸所含的分子数相等。若将上述硫酸配成500mL溶液,所得溶液的溶质的物质的量浓度为____。
(6分)选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液法 | B.加热分解 | C.蒸发结晶法 | D.分液法 E.渗析法 F.蒸馏法 G.过滤法 |
(1) ___________从氯化钠溶液中获得氯化钠固体;
(2) ___________分离溴水中的溴和水;
(3) ___________分离水和酒精;
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化: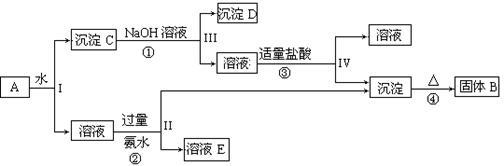
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
固体B;沉淀C;沉淀D。
(3)写出①、②、④三个反应方程式(属于离子反应的写离子方程式)
①;
②;
④。