(1)氨气是一种重要的化工原料,合成氨的原料气之一H2可通过反应:
CH4(g)+H2O(g) CO2(g)+3H2(g) △H=+161.1KJ/mol获取。已知温度、压强对甲烷平衡含量的影响如图1,请回答:
CO2(g)+3H2(g) △H=+161.1KJ/mol获取。已知温度、压强对甲烷平衡含量的影响如图1,请回答:
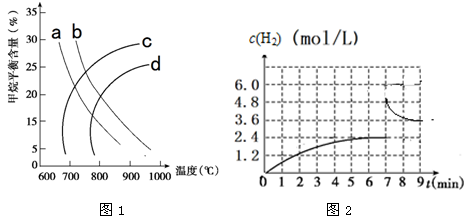
①图-1中a、b、c、d四条曲线中的两条代表压强分别为1Mpa、2Mpa时甲烷含量曲线,其中表示1Mpa的是________。
②已知:在700 ℃,1 MPa时,1 mol CH4与1 mol H2O在1 L的密闭容器中反应,6min达到平衡(如图2),该温度下反应的平衡常数为______________(结果保留小数点后一位数字)。
③从图2分析,由第一次平衡到第二次平衡,平衡移动的方向是_________(填“向正反应方向”或“向逆反应方向”),采取的措施可能是_____________________。
(2)工业上用NH3和CO2反应可合成尿素:
2NH3(g)+ CO2(g) CO(NH2)2(g)+ H2O(g)△H1=—536.1 kJ/mol。
CO(NH2)2(g)+ H2O(g)△H1=—536.1 kJ/mol。
①其他条件不变,下列方法能同时提高化学反应速率和尿素产率的是 。
| A.通入氦气 | B.缩小体积 |
| C.加入催化剂 | D.除去体系中的水蒸气 |
②尿素可用于处理汽车尾气。CO(NH2)2(g)与尾气中NO反应生成CO2、N2、H2O(g)排出。
又知:4NH3(g)+ 6NO(g)= 5N2(g) + 6H2O(g) △H2=-1806.4 kJ/mol,
写出CO(NH2)2(g)与NO反应的热化学方程式 。
(3)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂作为电极、加入碱性电解质溶液,其电池反应为 4NH3+3O2=2N2+6H2O。
①写出该燃料电池的正极反应式 。
②若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上9.75g锌,理论上至少需要消耗标准状况的氨气 L。
某铁矿石(只含金属氧化物和SiO2)溶于过量盐酸后,过滤所得滤液可用来制氧化铁涂料。
(1)向上述滤液中可加入 来证明含有Fe2+。
| A.酸性KMnO4溶液 | B.NaOH溶液 | C.溴水 | D.KSCN溶液+氯水 |
(2)若某铁矿石的质量为3.31g,溶于适量盐酸后,然后加过量碱溶液,生成沉淀,再灼烧沉淀,得2.40g Fe2O3.已知该铁矿石中铁的氧化物的质量分数为70%.试计算:
①该铁矿石中铁的质量分数 ②该铁矿石中铁的氧化物的化学式
(3)若滤液为1L AlCl3和FeCl3混合溶液,向其中加入含a mol NaOH的溶液时,产生的沉淀量可达最大值;继续加入NaOH溶液,沉淀开始溶解,当前后加入的NaOH总量达到b mol时,沉淀不再减少,则原溶液中Fe3+的物质的量浓度为
2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右。
资料:氰化钠化学式为NaCN,白色结晶颗粒或粉末,易潮解,有微弱的苦杏仁气味。剧毒,皮肤伤口接触、吸入、吞食微量可中毒死亡。熔点563.7℃,沸点1496℃。易溶于水,易水解生成氰化氢,水溶液呈强碱性,是一种重要的化工原料, 用于电镀、冶金和有机合成医药、农药及金属处理方面。
(1)用离子方程式表示其水溶液呈强碱性的原因:
(2)氰化钠要用双氧水或硫代硫酸钠中和。①用双氧水处理产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式 ;
②用硫代硫酸钠中和的离子方程式为CN-+S2O32-===A+SO32-,A为 (填化学式)。
(3)含氰废水中的CN-有剧毒。
①CN-中C元素显+2价, N元素显-3价,则非金属性N C(填<,=或>)
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为 。
③用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D.除去CN-的反应:2CN-+ 5ClO- + 2H+ ===N2↑ + 2CO2↑ + 5Cl-+H2O
(4)过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,也可用于含氰废水的消毒。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下: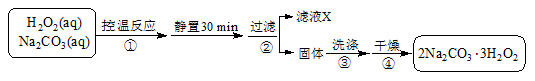
已知:2Na2CO3(aq)+ 3H2O2(aq) 2Na2CO3·3H2O2(s)ΔH < 0,请回答下列问题:
2Na2CO3·3H2O2(s)ΔH < 0,请回答下列问题:
①下列物质中,不会引起过碳酸钠发生氧化还原反应的有 。
A.FeCl3 B.CuSO4C.Na2SiO3 D.KCN
②准确称取0.2000g过碳酸钠于250mL锥形瓶中,加50 mL蒸馏水溶解,再加50 mL2.0 mol·L-1 H2SO4,用0.02000mol·L-1 KMnO4标准溶液滴定至终点时消耗30.00 mL,则产品中H2O2的质量分数为 。
[反应6KMnO4 + 5(2Na2CO3·3H2O2)+19H2SO4 = 3K2SO4 + 6MnSO4 +10Na2SO4 +10CO2 ↑ +15O2↑+34H2O]
有一无色溶液可能含Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32—、SO42— 等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示: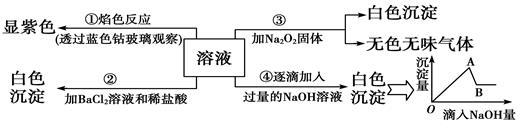
请你根据上图推断:
(1)原溶液中一定存在的离子有(写化学式):___________实验④最终产生的沉淀:_______________
(2)写出由A→B过程中所发生反应的离子方程式:_____________________。
(3)过氧化钠与水反应的化学方程式为:___________________
(4)实验②中加入稀盐酸的目的是________________。
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素。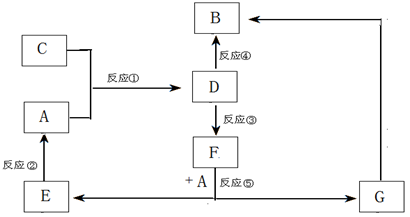
已知:A为金属单质,B为红褐色固体,E为密度最小的气体,G为浅绿色的溶液。
D的水溶液为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。
在水溶液中D能将某氧化物氧化为F,F是含有三种元素的化合物。请回答下列问题:
(1)构成C物质的元素在周期表中的位置是 ,在短周期主族元素中,该元素与其相邻元素的原子半径从大到小的顺序是 (用元素符号表示)。
(2)D的水溶液呈 性,请用离子方程式解释原因:
(3)上述反应中属于置换反应的是 (填序号)。
(4)反应③(即D将某种氧化物氧化为F)的离子方程式:
(5)气体C通入KI溶液中,氧化产物为KIO3,则氧化剂与还原剂物质的量之比为
(1)配平氧化还原反应方程式:
________C2O42-+________MnO4-+________H+===________CO2↑+________Mn2++________H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25.00 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1 NaOH溶液至20.00 mL时,溶液由无色变为浅红色。该溶液被中和的H+的总物质的量为________________mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液。
A.KMnO4溶液在滴定过程中作______________(填“氧化剂”或“还原剂”),该滴定过程______________(填“需要”或“不需要”)另加指示剂。滴至16.00 mL时反应完全,此时溶液颜色由________变为__________。
B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果______________(填“偏大”、“偏小”或“无影响”)。
C.若在达到滴定终点时俯视读数,则所得结果____________(填“偏大”、“偏小”或“无影响”)。
③原试样中H2C2O4·2H2O的质量分数为____________,KHC2O4的质量分数为______________。