取一定质量的氯化钠、溴化钠、碘化钠的混合物平均分成五等份,分别加水配成溶液并编号为甲、乙、丙、丁、戊,再分别向各溶液中通入一定体积的氯气,将反应后所得溶液蒸干,灼烧固体。通入氯气的量与最终所得固体质量记录如下:
| 编号 |
甲 |
 乙 乙 |
丙 |
丁 |
戊 |
| 固体组成 |
NaI、NaBr、NaCl |
|
NaBr、NaCl |
|
NaCl |
氯气的体积 /ml /ml |
V |
2V |
3V |
4V |
5V |
| 固体质量/g |
54.62 |
43.64 |
35.48 |
30.14 |
29.25 |
求:(1)请填写表中空白;
(2)标准状况下氯气的体积V为 ,原混合物中溴化钠的物质的量为
Na2CO3·10H2O与NaHCO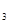 混合物4.54 g,溶于水配成100mL溶液,c(Na+)=0.4mol/L,另取等质量的混合物加强热至质量不变,求剩余固体的质量为多少?
混合物4.54 g,溶于水配成100mL溶液,c(Na+)=0.4mol/L,另取等质量的混合物加强热至质量不变,求剩余固体的质量为多少?
为测定某碳酸钠样品的纯度,取一定量碳酸钠(Na2CO3)样品投入到40mL未知浓度的盐酸中,两者恰好完全反应(杂质不参与反应),生成二氧化碳气体224mL(标准状况)。
(1)写出该反应的化学方程式________________________________________;
(2)碳酸钠的摩尔质量为___________________;
(3)该碳酸钠样品中碳酸钠的质量为______________;
(4)参与反应的盐酸的物质的量浓度______________;
某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96 g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33 g。另一份加入含0.001 mol KMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是和,阴离子是。
(2)试通过计算确定该结晶水合物的化学式。
向50mL0.5mol/L的硫酸铝溶液中加入1.5mol/L的KOH溶液多少毫升,可得到1.56gAl(OH)3白色沉淀?
(1)将100 mL浓度为1 mol·L-1的Na2CO3溶液滴入到浓度为1.2 mol·L-1的100 mL盐酸溶液中,计算生成CO2的体积(在标准状况下)。
(2)将100 mL浓度为1.2 mol·L-1的盐酸溶液逐滴滴入到浓度为1 mol·L-1的100 mL Na2CO3溶液中,计算生成CO2的体积(在标准状况下)。对比二者结果有何不同。