(12分) 恒容密闭容器中,某化学反应2A  B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验序号 |
浓度(mol/L) |
时间(min) |
|||||||
| 0 |
10 |
20 |
30 |
40 |
50 |
60 |
|||
| 1 |
温 度 |
8000C |
1.0 |
0.80 |
O.64 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
8000C |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
| 3 |
8000C |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
| 4 |
8200C |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在前20min内用B的浓度变化来表示的平均速率
为 mol/(L·min)。
(2)在实验2,A的初始浓度c2= mol/L,反应在 20分钟内就达到
平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1(用同种物质的浓度变
化表示),则达到平衡时υ3 υ1(填>、=、<=)
且c3 = mol/L。
(4)比较实验4和实验1,可推测该反应是 反应(选填“吸热”、“放热”)。
(5) 800℃时,反应2A  B+D的平衡常数= ,
B+D的平衡常数= ,
实验2中达到平衡时A的转化率= 。
甲醇是一种重要的有机化工原料,可用于制取甲醚。一定温度下,在三个体积均为1.0 L的恒容密闭容器中发生反应: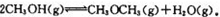
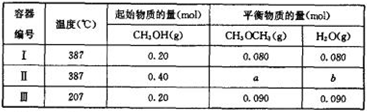
(1)该反应的化学平衡常数表达式为K=。
(2)该反应的正反应为(填“放热”或“吸热”)反应。
(3)容器Ⅰ中的反应达到平衡时所需的时间(填“大于”“小于”或“等于”) 容器Ⅱ中的
(4)a=,b=
(5)已知下面两个反应(m、n均大于0):
反应①: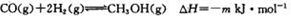
反应②: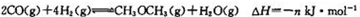
则下列m与n的关系中,正确的是(填字母)。
A n>2m B m>2n C n=m D m>3n
氮的氧化物对人体危害极大,实验时应防止其对空气的污染。
实验一:某同学利用下列装置实现铜与浓硝酸、稀硝酸的反应。
Ⅰ、取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3]。
Ⅱ、将洗涤后的铜丝做成匝数较多的螺旋状。
Ⅲ、按如图所示装置连接仪器、检查气密性、装入化学试剂。
(1)请完成过程Ⅰ发生反应的离子方程式:
Cu2(OH)2CO3+4H+=。
(2)过程Ⅲ的后续操作如下:
① 为使浓硝酸与铜丝接触,操作是打开止水夹a和b,,当红棕色气体较多时,轻抽注射器使反应停止,关闭a,取下注射器。生成红棕色气体的化学方程式是。
② 控制b与分液漏斗活塞,玻璃管充满稀硝酸时,关闭b打开a,可见有无色气体产生。稀硝酸充满玻璃管的目的是。
实验二:NO2与水反应的实验研究。
(3)将3支充满红棕色气体的小试管分倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致。结果如下表所示(忽略温度对气体体积的影响):
① 根据上表得出的结论是温度越(填“高”或“低“),进入试管中的溶液越多。
② 查阅材料:a.NO2与水反应的实际过程为:2NO2+ H2O=HNO3+ HNO2,3 HNO2= HNO3+2NO↑+H2O;b. HNO2不稳定。则产生上述现象的原因是。
1808年,英国化学家用钾还原氧化镁,最早制得少量的镁。镁是航空工业的重要材料,镁作为一种强还原剂,还用于钛、铍和铀的生产中。
(1)镁在元素周期表中的位置为。
(2)写出用镁与金红石(主要成分为TiO2)在加热条件下制取钛的化学方程式:
。
(3)镁在加热的条件下还能与NaOH固体反应,生成MgO和单质X、单质Y。已知X与水反应可生成单质Y,则镁与NaOH反应的化学方程式为:。
(4)镁一过氧化氢电池的工作原理如图所示,该电池放电时总反应的化
学方程式为:
硫、氯及其化合物有广泛的用途。
(1)“氯氧化法”是指在碱性条件下用Cl2将废水中的CN-氧化成无毒的物质。CN-被氧化后的产物为(填化学式)。
(2)“氯胺(NH2Cl)消毒法“是在用液氯处理自来水的同时通入少量的氨气,发生反应: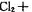
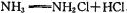 ,生成 的NH2Cl能部分水解生成强氧化性的物质,起消毒杀菌的作用。氨氯能用于消毒杀菌的原因是(用化学方程式表示)。
,生成 的NH2Cl能部分水解生成强氧化性的物质,起消毒杀菌的作用。氨氯能用于消毒杀菌的原因是(用化学方程式表示)。
(3)如图所示装置和药品可用来制备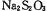 。
。
①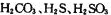 三种酸的酸性由强到弱的顺序位。
三种酸的酸性由强到弱的顺序位。
②配平广口瓶中生成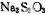 反应的化学方程式:
反应的化学方程式:
(共14分)氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。
(1)以氨为燃料可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用。若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为。
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2 2NH3。该可逆反应达到平衡的标志是________________。
2NH3。该可逆反应达到平衡的标志是________________。
| A.3v(H2)正=2v(NH3)逆 |
| B.单位时间生成m mol N2的同时消耗3m mol H2 |
| C.容器内的总压强不再随时间而变化 |
| D.混合气体的密度不再随时间变化 |
E.a molN≡N键断裂的同时,有6amolN—H键断裂
F.N2、H2、NH3的分子数之比为1∶3∶2
(3)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
| 压强/MPa |
16.80 |
14.78 |
13.86 |
13.27 |
12.85 |
12.60 |
12.60 |
则从反应开始到25min时,以N2表示的平均反应速率=;该温度下平衡常数K=;
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g) ="=" NH2CO2 NH4(s)△H=" —l59.5" kJ/mol
②NH2CO2NH4(s)  CO(NH2)2(s)+H2O(g)△H="+116.5" kJ/mol
CO(NH2)2(s)+H2O(g)△H="+116.5" kJ/mol
③H2O(1) ="=" H2O(g)△H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式;
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为a Pa,若反应温度不变,将体系的体积增加50%,则P[H2O(g)]的取值范围是_________________(用含a的式子表示)。(分压=总压×物质的量分数)