氧化二氯是黄棕色具有强烈刺激性的气体。它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1∶100)同时反应生成次氯酸溶液.制备出之后要冷却为固态才便于操作和贮存。制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO·HgCl2)。装置如图,铁架台和夹持仪器已略去。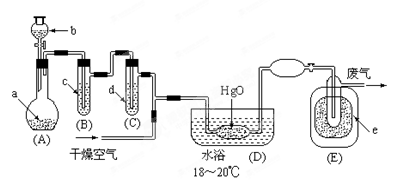
部分物质的有关物理数据如下:
| 化学式 |
熔点(单位:℃) |
沸点(单位:℃) |
| N2 |
-209.86 |
-195.8 |
| O2 |
-218.4 |
-183 |
| CO2 |
-57 |
/ |
| NH3 |
-77.3 |
-33.35 |
| Cl2 |
-101 |
-34.6 |
试回答:
(1)A中盛有深色固体试剂a是 ,分液漏斗中b试剂是 。
(2)B中盛有液体c是 ,C中的液体d是 。
(3)D中发生化学反应的化学方程式是 。
(4)E中的保温瓶中盛有致冷剂,它应是 (在干冰、冰水、液态空气、液氨中选择)。在E的内管得到的Cl2O中可能含有的主要杂质是 。
(5)装置A、B、C间的连接方式与D、E间的连接方式有明显的区别,这区别是 ,用这些不同的连接方式的主要理由是 。
(6分)实验室常用甲装置制取氯气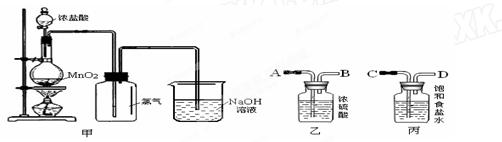
(1)写出实验室制取氯气的化学方程式并标明电子的转移______________ ___________________
___________________
(2)甲同学认为该装置制得的氯气不纯,在收集氯气之前应补充乙、丙两实验装置,你认为应如何连接(用ABCD字母连接) _____________饱和食盐水的作用是_________ _________
_________
(6分) 下图表示配制100 mL 0.100 mol·L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题: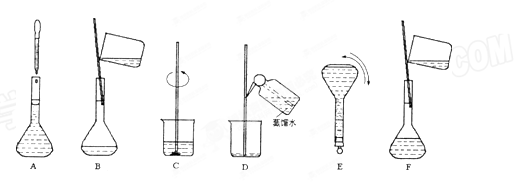
(1)步骤E中将一玻璃仪器上下颠倒数次,该仪器的名称是______。
(2)步骤B通常称为转移,步骤A通常称为____________。
(3)将上述实验步骤A—F按实验过程先后次序排列____________。
某生用0.1000mol/L的KOH标准溶液滴定未知浓度盐酸,其操作可分解为如下几步:
| A.移取20.00mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞 |
| B.用标准溶液润洗滴定管2~3次 |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准KOH溶液注入碱式滴定管至刻度0以上2~3cm |
E、调节液面至0或0以下刻度,记下读数
F、把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)。
(2)上述B步骤操作的目的是。
(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果的影响是。
(4)判断到达滴定终点的实验现象是:。
(5)若称量一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸则对滴定结果的影响是。
工业上制取CuCl2的生产流程如下: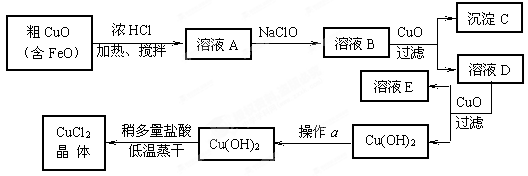
请结合下表数据,回答下列问题:
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| 完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
⑴ 溶液A中加入NaClO的目的是;
此反应离子方程式为;
⑵ 在溶液B中加入CuO的作用是;
⑶ 操作a的目的是;
⑷ 在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是。
某学生为测定未知浓度的硫酸溶液,以0.1400mol/L的NaOH溶液滴定上述H2SO4,取待测硫酸25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)若使用甲基橙做指示剂,如何确定终点 (2)下列操作将导致测定值高于实际值的是
| A.标准液在“0”刻度线以上,未予调整就开始滴定 |
| B.碱式滴定管用蒸馏水洗涤后未用标准NaOH溶液润洗 |
| C.观察记录滴定管内液面刻度时滴定前仰视,滴定后俯视 |
| D.酸滴定管经蒸馏水洗净后,即注入锥形瓶进行中和滴定 |
E.在滴定过程中不慎将数滴酸液滴在锥形瓶外
(3)计算待测硫酸溶液的物质的量浓度为 mol/L(计算出结果到小数点后二位)