汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g) N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K)。
N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K)。
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为________。
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |
(2)该反应达到平衡时若增大压强,则混合气体的平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”)。
(3)在如图中画出在某时刻条件改变后的图象(其他条件不变),在_______时间段CO的转化率最大。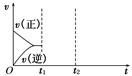
t1:增大NO的浓度 t2:降低温度
(4)通过计算判断该条件下反应能否自发进行。
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
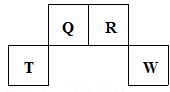
(1)T的原子结构示意图为;
(2)元素的非金属性:QW(填“>”或“<”);
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为;
(4)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是;
(一)短周期A、B、C、D 四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,可生成一种原子个数比为1:1的且不溶于水的固体E;D的L层电子数等于K、M两个电子层上电子数之和。
(1)A元素的名称为(2)B原子的阴离子的结构示意图为。
(3)C元素位于元素周期表中第周期、第族。
(4) D的质子数和中子数相等,它的最高价氧化物对应的水化物化学式为:。
(二)根据元素周期表及其元素周期律回答下列问题:
(1)预测52号元素在周期表中的位置:第周期族。
(2)已知硒为第四周期第ⅥA族元素,据此推测硒不可能具有的性质是()
A.最高正化合价为+6价, B.气态氢化物比H2S稳定,
C.最高价氧化物的水化物的酸性比硫酸弱, D.单质在常温下可与氢气化合。
(3)已知X为ⅡA族元素,其原子序数为a,Y与X位于同一周期,且为ⅢA族元素,则Y的原子序数b=(写出b与a所有可能的关系)。
航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置,它可直接将化学能转化为电能。我国发射的“神舟五号”载人飞船是采用先进的甲烷电池为电能来源的,该电池以KOH溶液为电解质,其总反应的化学方程式为:CH4+2O2+2OH-===CO32-+3H2O。
(1)电极反应正极___________________负极______________________。
(2)消耗标准状况下的5.6 L O2时,有________mol电子发生转移。
(3)开始放电时,正极附近溶液的pH________(填“增大”“减小”或“不变”)。
A、B、C、D、E各物质的转化关系如右图所示。
(1)当A为气体单质时,A是(写化学式)。
写出下列反应的化学方程式,并回答有关问题:
①A→B:;
②E→C: ;
(2)当A为固体单质时,A是(写化学式)。
写出下列反应的化学方程式:
①C→D:;
②E与木炭反应:。
(4分)配平下列反应方程式并标出双线桥
KClO3+KCl+H2SO4—Cl2↑+K2SO4+H2O