[化学—选修2:化学与技术]
将海水淡化与浓缩海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓缩海水中通过一系列工艺流程提取其他产品。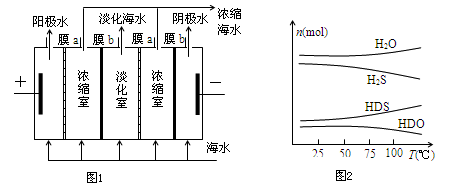
(1)如图1,用惰性电极在电场中利用膜技术(阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)淡化海水,该方法称为电渗析法。
①图1中膜a应选择_____________膜,阳极的电极反应式为_________________;
②电渗析法还可以用来处理电镀废液,写出用该方法处理含硫酸铜废液时(使用惰性电极)所发生的电极反应:阴极_________________阳极_________________;
(2)海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称。工业上是将氯气通入到含溴离子的浓缩海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴。该方法中反应的离子方程式依次为①Cl2+2Br-=Br2+2Cl-
②3Br2+3CO32-=BrO3-+5Br-+3CO2↑③_____________________________;产生1molBr2时,该反应转移的电子数为____________。
(3)海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢-水双温交换法”富集HDO.其原理是利用H2S、HDS、H2O和HDO四种物质,在25℃和100℃两种不同温度下发生的两个不同反应得到较高浓度的HDO. 如图2为“硫化氢-水双温交换法”所发生的两个反应中涉及的四种物质在反应体系中的物质的量随温度的变化曲线.写出100℃时所发生的反应的化学方程式_________________________;工业上富集HDO的生产过程中,可以循环利用的一种物质是____________。
在氮的单质和化合物中,遇到HCl会产生白烟的是;与氢氧化钙加热发生反应产生刺激性气味气体的是。(用字母填空)
| A.氮气 | B.氨气 | C.硝酸钠 | D.氯化铵 |
食品和药物安全是党和国家高度重视的民生问题。请你根据题意,用下列选项的字母代号填空。
| A.阿司匹林(乙酰水杨酸) | B.青霉素 | C.抗酸药(氢氧化铝) | D.麻黄碱 |
(1)可治疗支气管哮喘,但不宜过多服用的药物是。
(2)治疗胃酸过多,但患有严重的胃溃疡,应该选择。
(3)是一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是。
(4)能使发热的病人体温降至正常,并{007}起到缓解疼痛的作用,该药物是。
实验室有如图所示的实验装置:
已知氨气(NH3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水。在实验室中通常用加热固体氯化铵和氢氧化钙的混合物来制取氨气。试回答下列问题:
①实验室制取氨气可以选用_____________装置,收集氨气可以选用_______装置。
②试写出实验室制取氨气的化学反应方程式:
③如何检验收集的气体是氨气?试写出方法和结论:
为了达到下列表格中的实验要求,请从供选择的化学试剂中选出合适的试剂,将其标号填入对应的空格中。
下图中A~G均为中学化学中常见的物质,它们之间有如下转化关系。常温下,A为紫红色金属固体,B为常见的强酸,G为地壳中含量最多元素组成的气态单质;D、F都是大气污染物,主要来源于汽车尾气,D为无色气体,F为红棕色气体。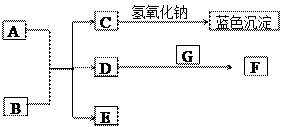
请回答以下问题:
①D的化学式是;C+NaOH生成的蓝色沉淀是(填化学式);
②构成G单质的元素在元素周期表中的位置为;
③写出B的稀溶液与A反应的化学方程式:。