以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐,电池总反应方程式为:C3H8 +5O2 = 3CO2+ 4H2O。
(1)已知: 2C3H8(g) + 7O2(g) =" 6CO(g)" + 8H2O(l) ∆H1
C(s) + O2(g) = CO2 (g) ∆H2
2C(s) + O2(g) = 2CO(g) ∆H3
则C3H8(g) +5O2((g) = 3CO2(g) + 4H2O(l) ∆H= (用∆H1、∆H2、∆H3表示)
(2)写出该电池正极的电极反应式: ,电池工作时CO32-移向 ;用该电池电解1000 mL 1mol/L的AgNO3溶液,此电解池的反应方程式为 ;当电池消耗0.005 mol C3H8时,被电解溶液的pH为 (溶液体积变化忽略不计)。
加碘食盐中加入的碘酸钾是一种白色结晶粉末,其溶解度受温度影响很大,且随温度的升高而逐渐增大,常温下很稳定,在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物等还原性物质发生反应。
(1)为检验某食盐中是否含有KIO3,某同学取食盐样品完全溶解于水中,然后加入用盐酸酸化的淀粉KI溶液,结果溶液呈蓝色,则反应的离子方程式为;
(2)KIO3也可用电解的方法制得,其原理是以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则两极的电极反应式分别为:阴极,阳极。
(1)按系统命名法为下列有机物命名

①,②;
(2)根据名称写出有机物结构简式
2,5-二甲基-4-乙基庚烷;
(3)戊烷(C5H12)的某种同分异构体只有一种一氯代物,试书写戊烷此同分异构体的结构简式: ;
(4)有两种有机物都含有碳92.3%,含有氢7.7%,第一种有机物对氢气的相对密度为13,第二种有机物的蒸气密度为3.49 g/L(已折算成标准状况下的值), 则第一种有机物的结构简式为,第二种有机物的分子式为。
北京时间2013年12月2日凌晨1时30分,我国的“嫦娥三号”月球探测器在西昌卫星发射中心发射升空,发射“嫦娥三号”月球探测器的火箭推进器中装有还原剂肼(N2H4)和氧化剂N2O4,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol气态肼和足量N2O4气体反应生成氮气和水蒸气时放出219.3 kJ的热量。
(1)写出肼和N2O4反应的热化学方程式:;
(2)已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g气态肼与足量N2O4气体反应生成氮气和液态水时,放出的热量是;
(3)肼除应用于火箭燃料外,还可作为燃料电池的燃料,由肼和空气构成的碱性燃料电池的负极反应式为:,正极反应式为:;
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼,写出反应的离子方程式:。
如图是测定铝粉(含镁粉)的纯度的实验装置。所用的NaOH(足量)的物质的量浓度为4.5 mol·L-1。不同时间电子天平的读数如下表所示: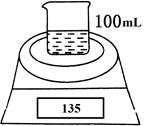
| 实验操作 |
时间/min |
电子天平的读数/g |
| 烧杯+NaOH溶液 |
0 |
120 |
| 烧杯+NaOH溶液+样品 |
0 |
135 |
| 1 |
134.5 |
|
| 2 |
134.1 |
|
| 3 |
133.8 |
|
| 4 |
133.8 |
(1)反应中生成气体的质量g。
(2)试计算样品中铝的质量分数。(写出解题过程)
(3)反应后溶液(溶液的体积变化忽略)的c(OH-)。(写出解题过程)
有关物质间转化关系如下图,试回答:
(1)转化①的反应条件为 .
(2)转化②的化学方程式为.转化③的离子方程式为.
(3)若转化⑤用于实验室制Al(OH)3,则试剂A宜选择(填名称).
(4)向50 mL 3 mol·L-1 AlCl3溶液中滴加1 mol·L-1 NaOH溶液,结果Al3+离子有1/3转化为Al(OH) 3沉淀,则加入的NaOH溶液的体积可能为或mL。