下列各组物质中括号中为杂质,请填写除去杂质所用的试剂及反应的离子方程式:
(1).NaHCO3溶液(Na2CO3),用__________ 试剂,离子方程式___________ 。
(2).CO2(HCl),用___________ 试剂,离子方程式 。
探究外界条件对化学反应速率的影响常用到该反应
已知:Na2S2O3+H2SO4→Na2SO4+S↓+SO2+H2O
针对上述反应涉及到的元素或物质及性质回答有关问题:
23.硫元素的化合价由高到低顺序为:______________________________
涉及元素的简单离子半径由小到大顺序为:______________________________;
24.氧原子的最外层电子排布轨道表示式:______________________________;
列举2个能说明氧、硫两种元素非金属性强弱事实:______________________________;
25.预测镁在二氧化硫中燃烧的现象:________________________________________
产物除氧化镁、硫磺外还可能有生成。
26.下面是某同学是根据该反应实验数据绘制的图表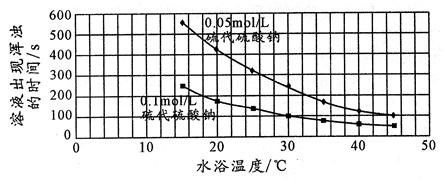
该同学得出的结论是:
_________________________________________________________________________________。
27.将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。
_________________________________________________________________________________。
若继续通入另两种气体如Cl2和H2S也会产生沉淀,请用化学方程式表示生成沉淀的原理。
_________________________________________________________________________________。
(本题共12分)
M(结构简式: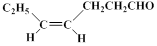 )不溶于水,是一种昂贵的食用香料,也是重要的医药中间体。M的一条合成路线如下(部分反应试剂和条件略去),且D与M互为同分异构体。
)不溶于水,是一种昂贵的食用香料,也是重要的医药中间体。M的一条合成路线如下(部分反应试剂和条件略去),且D与M互为同分异构体。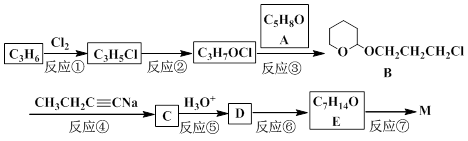
已知︰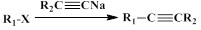
完成下列填空:
50.写出反应类型。 反应①_____________反应⑦_____________
51.写出结构简式。 A_________________ D__________________
52.写出检验E已完全转化为M的方法_______________________________。
53.写出一种满足下列条件C的同分异构体的结构简式(不考虑立体异构)___________。
i.能发生银镜反应
ii.无环状结构
iii.分子中有2种化学环境不同的氢原子
54.完成以C3H6为有机原料制备丙酸(CH3CH2COOH)(其他无机原料任选)的合成路线。
(合成路线的常用表示方法为: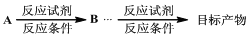 )
)
55.反应③的目的是_______________________________________________________。
(本题共10分)
水杨酸(结构简式: )及其衍生物冬青油(结构简式:
)及其衍生物冬青油(结构简式: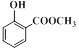 )和阿司匹林(结构简式:
)和阿司匹林(结构简式: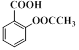 )都是常用的药物。
)都是常用的药物。
完成下列填空:
45.由水杨酸制备冬青油的反应试剂和反应条件是___________________。
46.冬青油中溶有少量水杨酸,请使用一种试剂提纯冬青油,并简要叙述实验方案。________________
47.水杨酸在浓硫酸催化作用下与乙酸酐反应生成阿司匹林。在此过程中,少量的水杨酸会发生聚合反应,请写出该聚合物的结构简式:__________________________。
48.阿司匹林晶体中残留少量的水杨酸,可用______________(填试剂名称)检验。实验室利用阿司匹林和水杨酸在乙酸乙酯中溶解度的差异,用结晶法提纯阿司匹林,请完成以下实验操作步骤:
①用少量热的乙酸乙酯溶解晶体。
②__________________________。
③经__________________操作得到纯净的阿司匹林晶体。
49.用聚甲基丙烯酸、乙二醇和阿司匹林可合成疗效更佳的长效缓释阿司匹林(结构简式如图所示),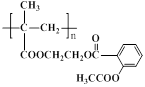
写出该合成过程的化学方程式:______________________________________________________
(本题共12分)聚合氯化铝(PAC)的化学式为[Al2(OH)nCl6-n·xH2O]m,它是一种新兴的高效净水剂。
某兴趣小组尝试以工业废弃物铝灰为原料,利用酸溶法制备聚合氯化铝,主要流程如下:
完成下列填空:
40.用37.5%的浓盐酸配置100 mL 6 mol/L盐酸,所需的玻璃仪器有量筒、烧杯、_______。
41.步骤III调节pH至4.0~4.5,其目的是___________________________。为使得到的PAC晶体较纯净,所用的X物质可以是_______(填编号)。
a.氨水b.铝c.氢氧化铝d.偏铝酸钠
42.步骤IV需要保持温度在85℃,可采用的加热方法是_____________。
43.为测定PAC样品中n的值,可以采用如下方法:
①称取一定质量样品,充分研碎后在_________(填仪器名称)中加热、灼烧至质量不再变化,得到1.020g固体,其成分是_________(填化学式)。
②另称取相同质量的样品,用_________(填化学式)溶解后,加入足量AgNO3溶液,得到3.157 g白色沉淀。
由上可知,该PAC样品中n的值为___________。
44.也可用烧碱溶解铝灰,再用稀盐酸调节pH至4.0~4.5,该法称为“碱溶法”。与“酸溶法”相比,“碱溶法”的缺点是______________________________(任写一点)。
(本题共12分)石油脱硫废气中含有较多的硫化氢,如何对其进行综合利用回收硫是研究的热点。完成下列填空:
35.实验室用启普发生器制备硫化氢气体,原料可选用__________(选填编号)。
| A.稀盐酸与硫化铜 | B.稀硫酸与硫化亚铁 |
| C.稀硝酸与硫化锌 | D.浓盐酸与硫化钠 |
若要得到一瓶干燥纯净的硫化氢,除启普发生器外,还应选用的装置依次是____(填编号)。
36.如图,将充满相同体积(同温同压)的二氧化硫与硫化氢气体的集气瓶对口放置,抽去毛玻璃片充分反应。观察到的现象是_______________________。检验最终剩余气体的方法是______________。
37.一种回收硫的方法称为克劳斯法,其主要流程是先将部分H2S氧化为SO2,再与剩余H2S作用。若废气中含67.2 m3 H2S,为充分回收硫,需要消耗空气_____m3(设空气中O2的体积分数为0.20)。
38.工业上常用吸收-电解法回收硫。主要过程分两步:
第一步,用FeCl3溶液吸收H2S。此过程中溶液pH_____(填“增大”、“减小”或“不变”)。
第二步,过滤后对滤液进行电解,发生反应的离子方程式为:2Fe2++ 2H+  2Fe3+ + H2↑吸收-电解法的优势是:① H2S的吸收率高;②____________。有人提出,第二步可以改为向所得溶液中通入O2,也能实现同样的目的,此时发生反应的化学方程式为__________________________。
2Fe3+ + H2↑吸收-电解法的优势是:① H2S的吸收率高;②____________。有人提出,第二步可以改为向所得溶液中通入O2,也能实现同样的目的,此时发生反应的化学方程式为__________________________。
39.请再设计一种从硫化氢中回收硫的方法(用化学方程式表示)。_________________