(15分)我国是氧化铝生产大国,工业上每生产1 t氧化铝将排出1~2 t赤泥,赤泥大量堆积会对环境造成严重污染。赤泥中主要成分及含量:CaO约占46%、SiO2约占22%、Al2O3约占7%、Fe2O3约占11%、TiO2约占5%及少量其他物质。
⑴一种利用废弃赤泥的方法是将赤泥配成一定的液固比,作为一种吸收剂,吸收热电厂排放的含SO2的烟气,写出吸收SO2时可能发生的化学反应方程式______________________。
⑵为综合利用赤泥中的各种成分,某科研小组设计了如下工艺流程: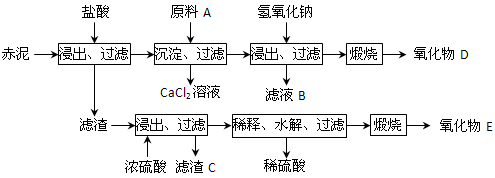
已知:TiO2不溶于稀盐酸、稀硫酸,能溶于浓硫酸生成TiOSO4(硫酸氧钛,易水解)。
①氧化物D的化学式是_____________,原料A最好是下列物质中的____________。
| A.氨水 | B.氢氧化钠 | C.生石灰 | D.双氧水 |
②写出上述工艺中投入氢氧化钠时反应的离子方程式:
______________________________________________________。
③写出上述工艺中稀释时发生水解反应的化学方程式:
______________________________________________________。
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
能形成双原子分子,原子间存在3对共用电子对 |
| X |
M层有3个电子 |
| Y |
最外层电子数是最内层电子数2倍,其最高价氧化物是一种固体,用于生产光导纤维 |
| Z |
最低负价为—2价,且无最高正价 |
用化学符号回答以下问题:
(1)比较:氢化物的稳定性:TZ,最高价氧化物对应水化物的酸性: TY。(填“>”、“<”或“=”)
TY。(填“>”、“<”或“=”)
(2)写出T的氢化物的电子式:。
(3) X的最高价氧化物对应水化物与烧碱反应的离子方程式为:
(4) T、X、Y、Z四种原子的半径由大到小的顺序为:。
在下列物质中:① CO2② KCl ③ CaBr2④ O2⑤ NH4Cl⑥ Ca(OH)2⑦ N2⑧ HBr⑨ NH3⑩ Na2O2
(1)有离子键也有非极性键的是(2)属于离子化合物的是
(3)只有非极性键的是(4)只有离子键的是
(12分) A、B、C、D四种元素均属于短周期元素,且原子序数依次增大,A与B能组成 原子数之比为2∶1的化合物X和1∶1的化合物Y,D与B也能组成原子数之比为2:1的化合物M和1:1的化合物Z;1molC单质跟X反应放出0.5mol气体B2,1molD单质跟X反应放出11.2L(标准)气体A2,1molZ化合物跟X反应放出0.5mol气体B2。试回答:
原子数之比为2∶1的化合物X和1∶1的化合物Y,D与B也能组成原子数之比为2:1的化合物M和1:1的化合物Z;1molC单质跟X反应放出0.5mol气体B2,1molD单质跟X反应放出11.2L(标准)气体A2,1molZ化合物跟X反应放出0.5mol气体B2。试回答:
(1)A、B、C、D的元素符号:ABCD
(2)这四种元素形成的四种简单离子的半径大小顺序为____________________;[
(3)这四种元素的原子半径大小顺序为 _________________________________;
(4)C与X反应的化学方程式
(5)Z与X反应的离子方程式
(14分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2[ |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧[] |
|||
| 4 |
⑨ |
(1) 在这些元素中,化学性质最不活泼的是:(填具体元素符号或化学式,下同)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的电子式是:_____________。
(3) 最高价氧化物是两性氧化物的元素是_________;写出它的氧化物与氢氧化钠反应的离子方程式____________________________________。
(4) 用电子式表示元素④与⑥的化合物的形成过程:,该化合物属于(填 “共价”或“离子”)化合物[
市场上出售的“热敷袋”其主要成分是铁屑、炭粉和少量的NaCl、水等。热敷袋在启用前用塑料袋使之与空气隔绝,启用时,打开塑料袋轻轻揉搓,就会放出热量,使用完后,会发现袋内有许多铁锈生成。回答:
(1)热敷袋放出的热量来源于_________放出的热量。
(2)炭粉的作用是________________________。
(3)加入NaCl的作用是________________________。
(4)写出有关电极反应式和化学方程式________________。