Ⅰ.在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,
已知a+b=12,则:
该温度下,水的离子积常数Kw= 。
该温度下,将10mL 0.1mol/L的稀硫酸与10mL 0.4mol/L的NaOH溶液混合后,溶液的pH= ,此时该溶液中由水电离的c(OH-)= mol/L。(忽略体积变化)
Ⅱ. 根据2CrO42-(黄)+2H+ =Cr2O72-(橙)+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,电解一段时间后,右边溶液逐渐由黄色变为橙色。图中右侧电极连接电源的 极,其电极反应式为 ,通电完成后,若转移0.1mol电子,则阴极区和阳极区的质量差为 g。(已知电解前两极区溶液质量相同)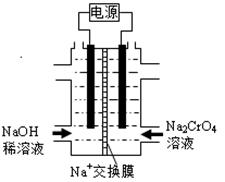
下列物质中:①NaCl ②Na2O ③CH3COOH ④CO2 ⑤NaHCO3 ⑥NH3·H2O ⑦HCl ⑧NaOH ⑨Cl2 ⑩酒精 请按要求回答下列问题(填编号):
(1) 属于电解质的有 ;(2)属于非电解质的有: ;
(3)属于强电解质的有;(4)属于弱电解质的有;
(5)请分别写出NH3·H2O ,NaHCO3的电离方程式:;。
硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。 已知:①Fe3+、Al3+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2和12.4;Al(OH)3完全溶解的pH为11.8。②常温下,饱和氨水的pH约为11。
已知:①Fe3+、Al3+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2和12.4;Al(OH)3完全溶解的pH为11.8。②常温下,饱和氨水的pH约为11。
请回答:(1)写出A与氢氧化钠溶液反应的化学方程式:。
(2)上述流程中试剂②应该是(填以下字母编号)。
| A.氢氧化钠 | B.氧化铝 | C.氨水 | D.水 |
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是
。
(4)计算溶液F中c(Mg2+)=( 25℃时,氢氧化镁的Ksp=5.6×10-12)。
(5)工业生产中将固体C灼烧后的产物与KNO3、KOH固体加热共熔制备净水剂K2FeO4,同时获得一种亚硝酸盐,请写出制得K2FeO4的化学方程式:。
碳及其化合物有广泛的用途。
(1)写出用碳棒作电极电解饱和食盐水的离子方程式: 。 (2)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)
(2)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)
ΔH=" +131.3" kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是。
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
 (3)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
(3)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
| 温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2O |
CO |
H2 |
CO |
||
| 900 |
1.0 |
2.0 |
0.4 |
1.6 |
3.0 |
通过计算求出该反应的平衡常数(写出计算过程,结果保留两位有效数字)。
(4)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)  2NH3(g)ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g)ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为,判断依据是。
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在下图中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。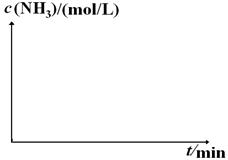
化合物IV为一种重要化工中间体,其合成方法如下: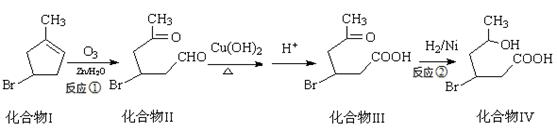
(1)化合物I的化学式为。
(2)化合物Ⅱ具有卤代烃的性质,在一定条件下能生成烯,该反应条件是。
(3)1mol化合物III与足量NaOH反应消耗NaOH的物质的量为mol。
(4)化合物IV能发生酯化反应生成六元环化合物V,写出该反应的化学方程式
。
(5) 异黄樟油素( 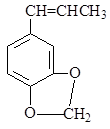 )发生类似反应①的反应,得到一种环状化合物Ⅵ(一种香料),化合物Ⅵ的结构简式为______________________。
)发生类似反应①的反应,得到一种环状化合物Ⅵ(一种香料),化合物Ⅵ的结构简式为______________________。
维生素C的结构如右,它是人体维持正常生命过程所必需的一类有机物,主要来源于新鲜的蔬菜和水果中。请回答以下关于维生素C的问题。
(1)维生素C的类别是(填序号)。
A.芳香族化合物 B.酚类化合物 C.醛类化合物 D.酯类化合物
(2)请写出维生素C的含氧官能团的名称 。
(3)关于维生素C说法正确的是(填序号)。
A.在一定条件下,能发生取代反应、加成反应、消去反应和氧化反应
B.能使FeCl3溶液呈紫色
C.能使酸性KMnO4溶液褪色
D.1mol维生素C能与2molH2反应