(14分)
Ⅰ.(每空1分) 已知某工业废水中含有大量的CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其他物质。
(1)步骤1需用到的玻璃仪器除烧杯外有 。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式) ,固体残渣的成分是(填化学式) 。
(3)步骤3中涉及的操作是:蒸发浓缩、 、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是 。
Ⅱ.((2)为1分,其余每空2分)某溶液中含有Na+、SO、SO、CO、Cl-、Br-中的若干种,依次进行下列实验,观察到的现象记录如下:①加入盐酸,有无色气体生成;②向原溶液中滴加氯水,无气体产生,再加CCl4振荡,静置,CCl4层呈橙色,用分液漏斗分液;③向分液后所得的水溶液中加入Ba(NO3)2和HNO3的混合溶液,有白色沉淀生成,过滤;④在滤液中加AgNO3和HNO3的混合液,有白色沉淀产生.试回答:(提示:氯气会氧化SO为SO)
(1)原溶液中肯定存在的离子是 ,肯定没有的离子是 ;
(2)若步骤③改用BaCl2和盐酸的混合溶液,对判断(1)结论有无影响 ;
(3)步骤②中发生反应的离子方程式为 、 .
下列各单质与化合物之间的关系如下图,单质及化合物的组成元素皆为短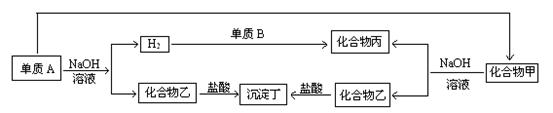
周期元素,请回答:
(1)若沉淀丁不溶于过量的盐酸,甲为 ;乙为 。
若沉淀丁能溶于过量的盐酸,丁为 。
(2)单质B一定是__________。写出丙的电子式: 。
(3)写出有关反应方程式
①沉淀丁不溶于过量盐酸时,写出A+NaOH的反应:
②沉淀丁能溶于过量盐酸时,写出化合物乙与过量盐酸反应的方程式:
有一工业烧碱(含氯化钠),现要求采用学过的定量实验的方法测定此工业烧碱中氢氧化钠的质量分数(假设各步实验中试样的损失忽略不计),请完成如下实验报告。
实验报告
(一)实验目的:工业烧碱中氢氧化钠的质量分数测定
(二)实验原理:(写出有关离子反应方程式):_____________________________,
(三)实验试剂:工业烧碱、标准浓度的盐酸、甲基橙。
(四)实验仪器:铁架台(成套)、天平、烧杯、锥形瓶、移液管、胶头滴管、100ml量筒、 ________、_______。
(五)按实验顺序填写实验步骤:(中和滴定法)
______、溶解、移液管量取一定体积的待测液于洁净的锥形瓶中、__________、用标准盐酸滴定至终点。
当滴定至溶液由______色变为_____色,且半分钟不腿色时停止滴定。在相同条件下重复二次。
(六)数据处理及问题讨论:
1、若要测定样品中氢氧化钠的质量分数,实验中至少需要测定那些实验数据?_______________________________________。
2、取a克样品,配置100mL溶液,取20mL待测液,用C mol/L的标准盐酸滴定至终点,消耗盐酸VmL。试写出样品中氢氧化钠的质量分数表达式为: 。
反应aA(g) +bB(g)cC(g)+d D(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为a∶b。则
(1)平衡时A与B的转化率之比是 。
(2)若同等倍数地增大A、B的物质的量浓度,要使A与B的转化率同时增大,(a+b)与(c+d)所满足的关系是(a+b) (c+d ) (填“>”“=”“<”或“没关系”)。
(3)设定a="2" ,b=1,c=3,d=2,在甲、乙、丙、丁4个相同的容器中A的物质的量依次是2 mol、1 mol、2 mol、1 mol,B的物质的量依次是1 mol、1 mol、2 mol、2 mol,C和D的物质的量均为0。则在相同温度下达到平衡时,A的转化率最大的容器是 ,B的转化率由大到小的顺序是 (填容器序号)。
海水是取之不尽的化工原料资源库,从海水中可提取各种化工原料。下图是工业上对海水的几项综合利用的示意图:
(1)由MgCl2·6H2O晶体脱水制无水MgCl2时,MgCl2·6H2O晶体在气氛中加热脱水,该气体的作用是
(2)电解无水MgCl2所得的镁蒸气可以在下列气体中冷却(选填代号)。
A H2 B N2 C CO2 D O2
(8分)在T℃时,水的离子积为KW=10—12,在此温度下,将pH=a的盐酸溶液Va L与pH=b的Ba(OH)2溶液Vb L混合:
(1)由数据可以判断T25(填“大于” 、“小于”、“等于”);理由是:。
(2)若所得混合液为中性,且a+b=10,则Va︰Vb为;
(3)若所得混合液的pH=10,且a=2,b=12则Va︰Vb为。