铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=FeSO4+Cu
上述两种方法中,铜元素均被__________ (填“氧化”还是“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下:
①步骤1中反应的离子方程式是_______________。
②步骤2所加的氧化剂最适宜的是____________________。
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到5,此时Fe3+浓度为__________
[Ksp(Fe(OH)3)=4×10-38],可选用的“试剂1”是__________(写出一种即可)。
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是_______________________ (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。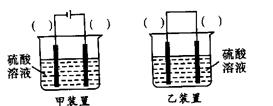
(3)欲实现反应Cu+H2SO4(aq)=CuSO4+H2↑,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)。并写出电极反应式。
已知某工业废水中含有大量FeSO4,较多的Cu2+,少量的Na+ 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。
|

 1的主要操作是 ,需用到的玻璃仪器有 , _______、 。
1的主要操作是 ,需用到的玻璃仪器有 , _______、 。
黑火药爆炸时发生如下的反应:2KNO3 + 3C + S = K2S + N2↑+ 3CO2↑ 该反应的氧 化剂是______、还原剂。
化剂是______、还原剂。
(1)写出下列物质在水溶液中的电离方程式
氢氧化钡硫酸铝
(2)写出下列反应的离子方程式或化学方程式:
硫酸溶液与澄清的石灰水混合
碳酸氢钠溶液与稀盐酸混合
MgO + 2H+ ==Mg2+ + H2O_____________________________________________
下表是生活生产中常见的物质,表中列出了它们的一种主要成分:
请你对表中①~⑦的主要成分进行分类(填编号)
属于盐的是_________,属于电解质的是________,属于非电解质的是_______。
 当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是。
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是。
⑷在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是。
28.(9分)下列一句话中叙述了两个值,前者记为M,后者记为N,M和N的关系从A、B、C、D中选择
A. M>NB. M<NC. M="N" D. 无法比较
⑴相同温度下,1L 1mol/L 的NH4Cl溶液中的NH4+个数和2 L 0.5mol·L-1NH4Cl溶液中NH4+的个数:;
⑵相同温度下,pH值为12的烧碱溶液中水的电离度和pH值为12的CH3COONa溶液中水的电离度:;
⑶两份室温时的饱和石灰水,一份升温到50℃;另一份加入少量CaO,恢复至室温,两溶液中的c(Ca2+):;
⑷常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中c(HCO3-):;
⑸将pH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的pH值:;
⑹常温下0.1mol/L的CH3COOH与0.1mol/LCH3COONa等体积混合后溶液中c(Na+)和c(CH3COO-):;
⑺同 温度下,0.1mol/LFeCl3溶液中Fe3+水解百分率与0.01mol·L-1FeCl3溶液中Fe3+的水解百分率:;
温度下,0.1mol/LFeCl3溶液中Fe3+水解百分率与0.01mol·L-1FeCl3溶液中Fe3+的水解百分率:;
⑻室温下某强酸和某强碱溶液等体积混合后,溶液的pH值为7, 原酸溶液和原碱溶液的物质的量浓度:;
原酸溶液和原碱溶液的物质的量浓度:;
⑼PH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的M倍和N倍,稀释后两溶液的PH值仍然相同,则M和N的关系是:。