X、Y、Z、L、M、N是六种原子序数依次增大的前四周期元素。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。N的核电荷数比L的核电荷数的3倍多2, 回答下列问题:
(1)X和Y可以形成10电子、14电子、18电子分子,写出X元素质子数和中子数相等的核素的符号 。由X和Y元素组成的14电子分子的电子式为 。
(2)在水溶液中 将Fe3+还原为Fe2+,
将Fe3+还原为Fe2+, +4Fe3+→4Fe2++……其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为______________________________。
+4Fe3+→4Fe2++……其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为______________________________。
(3)一定条件下,M与TiO2、C(石墨)反应只生成M的氧化物和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知。该反应生成lmol M的氧化物时放出536kJ的热量,其热化学方程式为 。
(4)Z元素的气态氢化物和最高价氧化物对应的水化物化合生成一种盐,该盐的水溶液呈 (填“酸”、“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序 。
(5)N的低价硫酸盐溶液与过氧化钠反应。若N的低价硫酸盐与过氧化钠的物质的量之比为2:1,且无气体生成,则该反应的离子方程式为 。
饮用水中含有一定浓度的NO3一将对人类健康产生危害,NO3一能氧化人体血红蛋白中的Fe(II),使其失去携氧功能。为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案:
请回答下列问题:
⑴已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3一反应的离子方程式为
__________________________________________。
⑵该方案中选用熟石灰调节pH,理由是_______________________、__________________,在调节pH时,若pH过大或过小都会造成的利用率降低。
⑶用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为____________________________________。
⑷饮用水中的NO3-主要来自于NH4+。已知在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
试写出1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是。
在2L密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表: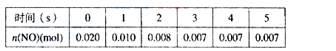
(1)写出该反应的平衡常数表达式:K=_____________。
已知:K(300℃)>K(350℃),该反应是________热反应。
(2)下图中表示NO2的变化的曲线是____________。
用O2表示从0~2s内该反应的平均速率v=___________。
(3)能说明该反应已经达到平衡状态的是___________。
a、v(NO2)=2v(O2) b、容器内压强保持不变
c、v逆(NO)=2v正(O2) d、容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a、及时分离出NO2气体 b、适当升高温度
c、增大O2的浓度 d、选择高效的催化剂
在密闭 容器中进行可逆反应: CO(g)+NO2(g)
容器中进行可逆反应: CO(g)+NO2(g)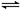 CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
①增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
②容器体积不变:若通入CO2气体,平衡 移动,反应混合物的颜色 。
若通入N2气体,平衡 移动,反应混合物的颜色 。③加入催化剂,平衡 移动。
在反应2KMnO4+16HCl 2KCl+2MnCl2+5Cl2↑+8H2O反应中,氧化剂是,氧化产物是;若有1mol KMnO4参加反应时,该反应转移电子的个数是;若反应生成11.2LCl2(标准状况)则被氧化的氯化氢为mol;请在下面方框中用“单线桥法”表示该反应中电子转移的方向和数目。
2KCl+2MnCl2+5Cl2↑+8H2O反应中,氧化剂是,氧化产物是;若有1mol KMnO4参加反应时,该反应转移电子的个数是;若反应生成11.2LCl2(标准状况)则被氧化的氯化氢为mol;请在下面方框中用“单线桥法”表示该反应中电子转移的方向和数目。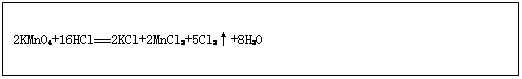
阅读下列材料后,回答相应问题。
一个体重50Kg的健康人大约含铁2g,这2g铁在人体中不是以单质金属形式存在,而是以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。
(1)人体中经常进行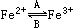 的相互转化,在A过程中,Fe2+做剂,在B过程中,Fe3+做剂。
的相互转化,在A过程中,Fe2+做剂,在B过程中,Fe3+做剂。
(2)“服用维生素C,可使食物中三价铁离子还原成二价铁离子。”这句话指出,维生素C在这一反应中做_剂,具有性。
(3)已知:氧化性Cl2> Br2> Fe3+, 还原性Fe2+>Br- >Cl-,则向0.2mol/L 1LFeBr2溶液中通入标准状况下氯气2.24L,被氧化的粒子是,此反应的离子方程式:。