阅读下面两条科普信息,回答问题:
(1)一个体重50Kg的健康人含铁2g,这2g铁在人体中不是以单质金属的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(2)在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛:CH2O表示)。
问题:
这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。这说明亚铁离子具有 性,铁离子具有 性
(1)中的维生素C是 剂,(2)中的CO2 剂。
在某一容积为5 L的密闭容器内,加入0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) 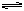 CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:
(1)根据图上数据,反应开始至达到平衡时,
CO的化学反应速率为v(CO)=mol/(L·min)-1,
该温度下的平衡常数K=。
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有
(填字母)
| A.升高温度 | B.降低温度 | C.增大压强 | D.减小压强 |
E.加入催化剂 G.移出一氧化碳气体
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=________________mol/L.
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,CO的转化率_______(填“升高”、“降低”还是“不变”),CO2的质量分数________(填“升高”、“降低”还是“不变”).
(5)在催化剂存在和800℃的条件下,在某一时刻测得C(CO)=C(H2O)= 0.09mol/L,
C(CO2 )=C(H2)=0.13mol/L ,则此反应是否处于平衡状态:(填“是”或“否”),若没有处于平衡状态则该反应向移动。(填“正方向”或“逆方向”)
现有以下物质:①NaCl晶体,②SO3,③冰醋酸,④铁丝,⑤BaSO4晶体,
⑥蔗糖,⑦乙醇,⑧熔融KNO3,请回答下列问题(填序号):
(1)以上物质中能导电的是;
(2)以上物质中属于非电解质,但其水溶液可以导电的是;
(3)以上物质中属于弱电解质的是;
按要求写出下列方程式
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式是:
(2)已知在25℃、101kPa时,CO的燃烧热为283kJ/mol,相同条件下,若2molCH4完全燃烧生成液态水,所放出的热量为1molCO完全燃烧放出热量的6.3倍,CH4完全燃烧反应的热化学方程式是:
(3)Al(OH)3的电离反应方程式:
(4)H2S的电离反应方程式:
(5)NaHSO4溶于水的电离方程式
某河道两旁有甲、乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO 六种离子。
六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是________、________、________。
(2)乙厂的废水中含有另外三种离子。如果加一定量________(选填“活性炭”“铁粉”),可以回收其中的________(填写金属元素符号)。
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的________(填写离子符号)转化为沉淀。经过滤后的废水主要含________,可用来浇灌农田。
A、B、C、D、E为易溶化合物,其离子组成为
| 阳离子 |
Fe3+、Ba2+、Al3+、Na+、Ag+ |
| 阴离子 |
NO3—、OH—、SO42—、Cl—、CO32— |
在各化合物中离子不重复,分别取其溶液进行实验,结果如下:
①在A溶液中逐滴加入氨水,有白色沉淀生成,继续加氨水至过量,沉淀消失;
②用pH试纸测得B和C溶液显碱性,0.1mol/L的C溶液pH小于13;
③在D溶液中加入铁粉,溶液质量增加;
④在E溶液中加入过量B,没有沉淀产生。
完成下列填空:
(1)A的化学式为;
(2)③反应的离子方程式为;
(3)检验D溶液中阴离子的的方法是;
(4)E的的化学式为,将E蒸干、灼热至质量不再改变,最后所得物质是(填化学式)。