将15.68L(标准状况)的氯气通入70℃.500mL氢氧化钠溶液中,发生了两个自身氧化还原反应,其氧化产物为次氯酸钠和氯酸钠。若取此溶液25mL,稀释到250mL,再取稀释后的溶液25mL用醋酸酸化后,加入过量碘化钾溶液充分反应,此时只有次氯酸钠氧化碘化钾。用浓度为0.20mol/L硫代硫酸钠(Na2S2O3)测定析出的碘:I2+2Na2S2O3=2NaI+Na2S4O6,需用硫代硫酸钠溶液5.0mL。将上述测定后的溶液再用盐酸调至强酸性,此时氯酸钠亦能氧化碘化钾,析出的碘再用上述硫代硫酸钠测定,又用了30.0mL。
(1)计算反应后溶液中次氯酸钠和氯酸钠的物质的量之比。
(2)用一个总化学方程式表示题中氯气通入70℃氢氧化钠溶液中所发生的化学反应。
(3)假设题中氢氧化钠溶液的体积在通入氯气前后的变化可忽略不计,请计算通入氯气后各生成物的物质的量浓度。
实验室用二氧化锰和浓盐酸反应制取氯气。
(1)若用200mL 10mol·L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化挥发),则产生氯气的物质的量为0.50mol(填“大于”、“等于”或“小于”),原因是。
(2)8.7g二氧化锰与足量的浓盐酸反应,则被氧化的氯化氢的物质的量是多少?产生的氯气在标准状况下的体积是多少?
现将足量的浓硝酸与铜反应,生成4.48L的 气体(标况下),求:
气体(标况下),求:
(1)参加反应的铜的质量;
(2)被还原的硝酸的物质的量;
(3)将得到的溶液稀释到500ml,求溶液中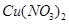 的物质的量浓度。
的物质的量浓度。
1.28g铜和一定量的浓硝酸反应,
(1)若反应生成的气体全部为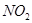 ,求消耗的
,求消耗的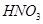 的物质的量。
的物质的量。
(2)若随着铜的不断减少,反应生成的气体的颜色也逐渐变浅。当铜全部反应时,共收集到标准状况下气体1.12L,求反应中消耗的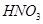 的物质的量。
的物质的量。
标准状况下1.68 L气态烃在足量氧气中完全燃烧。若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0 g;若用足量碱石灰吸收燃烧产物,增重9.3 g。
(1)计算燃烧产物中水的质量。
(2)通过计算推断气态烃的分子式。
6g某单质X能从盐酸中置换出0.3g H2,同时生成XCl2;另一种元素Y,它的最高价氧化物的化学式为YO3,在Y的氢化物中,Y的质量分数为94.1%。
(1)X、Y两元素的相对原子质量:X;Y。
(2)写出Y的另一种常见氧化物与足量X的最高价氧化物对应水化物反应的化学方程式。