为了测定某未知NaOH溶液的浓度,需要0.200mol·L-1的盐酸溶液500mL。某学生用实验室中常用的36.5%(密度为1.20g·cm-3)的浓盐酸配制所需稀盐酸,并设计了以下步骤完成实验。
⑴请你帮助该同学完成以下各步中的内容,并将其所设计的实验步骤正确排序。
A.用_____(从以下备选仪器中选取适当仪器,将其序号填入空格中)量取36.5%(密度为1.20g·cm-3)的浓盐酸________mL。a.50mL量筒; b.10mL量筒; c.托盘天平。
B.将取好的浓盐酸在烧杯中加适量蒸馏水稀释。
C.轻轻振荡后继续加蒸馏水到液面距离仪器刻线1~2cm处。
D.等溶液恢复至室温。
E.将溶液用玻璃棒引流转入______________________(填写所需仪器)中,再用适量蒸馏水洗涤烧杯和玻璃棒2 ~3次一并转入其中。
~3次一并转入其中。
F.用胶头滴管加蒸馏水直到溶液液面恰好与刻线相切,塞好瓶塞摇匀即可。
以上各实验步骤的正确排列顺序是___________________________________。
⑵准确移取20.00mL待测NaOH溶液于锥形瓶中,用所配标准盐酸溶液进行滴定(以酚酞为指示剂)。滴定结果如下表:据此计算未知NaOH溶液的物质的量浓度为____mol·L-1(精确到0.01)。
| 实验序号 |
滴定管液面起始读数 |
滴定管液面终点读数 |
| 1 |
1.32mL |
23.36mL |
| 2 |
2.26mL |
24.22mL |
⑶下列操作或叙述正确的是_____(填写序号)。
A.滴定过程中,眼睛注视滴定管内溶液并使视线与液面的凹面水平。
B.滴定过程中由于摇动锥形瓶使少许溶液溅起沾在瓶内壁,为使测定结果正确,可用少许蒸馏水将其冲入锥形瓶内的溶液中。
C.容量瓶和滴定管在使用前洗净后都要检查是否漏液。
D.向锥形瓶中移取NaOH溶液前,用少许NaOH溶液润洗锥形瓶2~3次。
⑷下列操作或现象会导致测定结果偏高的是_____________________(填写序号)。
A.滴定过程中不小心将一滴溶液滴在锥形瓶外;
B.滴定结束时,发现在滴定管尖嘴处有小气泡;
C.滴定结束后仰视滴定管液面读数;
D.溶液褪色立即读数,摇动锥形瓶后看到溶液红色复出;
E.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗,直接加入标准液进行滴定。
(15分)某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。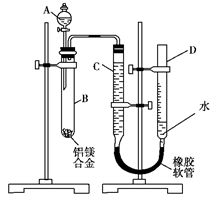
(1)A中试剂为。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是______________
___________________________________________________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥、称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性。上述操作的顺序是 (填序号);记录C的液面位置时,除视线平视外,还应__________________。
(4)B中发生反应的化学方程式为__________________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为 。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将 。(填“偏大”、“偏小”、“不受影响”)
立足教材实验是掌握高中化学实验的基础,是理解化学科学的实验原理、实验方法和实验思路,提高学生实验能力的基本途径。
(1)实验1:取一块金属钠,在玻璃片上用滤纸吸干表面的煤油后,用小刀切去一端的外皮。观察钠的颜色。这个实验中还需用到的一种仪器是;
(2)实验2:向一个盛有水的小烧杯里滴入几滴酚酞试液,然后把一小块钠投入小烧杯。把反应的现象和相应结论填入空格。“浮”---钠的密度比水小;“熔”--- ;“红”---反应生成了氢氧化钠;
(3)实验3:在两支试管里分别加入5mL 盐酸和5mL NaOH溶液,在各放入一小段铝片,观察实验现象。试写出铝和NaOH溶液反应的离子方程式:;
(4)实验4:把水滴入盛有Na2O2固体的试管中,立即用带火星的木条放在试管口,检验生成的气体。向反应后的溶液中加入酚酞试液,可以看到;
(5)实验5:在玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气。该氧化还原反应的氧化剂是;
(6)实验6:在试管里注入少量新制备的FeSO4溶液,用胶头滴管吸取NaOH溶液,将滴管尖端插入试管里溶液底部,慢慢挤出NaOH溶液,可以看到开始时析出一种白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色。发生这种颜色变化的原因是(用化学方程式表示):。
(7分)某同学为了验证氢气还原氧化铜的反应产物,设计了如下图所示的实验装置。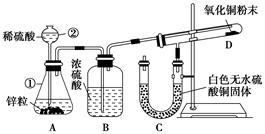
(1)写出编号仪器的名称:
①________,②________。
(2)浓硫酸的作用是_________________________________________________。
(3)本实验需要加热的装置为________(填字母编号)。
(4)写出装置C、D中可观察到的现象:C________,D________。
(5)D中反应每生成1个水分子,转移的电子数为________。
(12分)通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。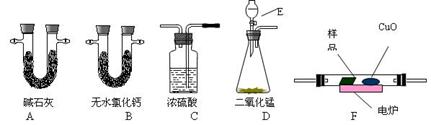
(1)现准确称取0.44g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重0.88 g,B管增重0.36g。请回答:
(1)按上述所给的测量信息,装置的连接顺序应是
D→→ F→;
(2)A、B管内均盛有固态试剂,A管的作用是______________________;
(3)E中应盛装什么试剂:_______________;
(4)如果把CuO网去掉,A管重量将_______;(填“增大”、“减小”或“不变”)
(5)该有机物的实验式为__________________;
(6)要确定该有机物的分子式,还必须知道的数据是___________。
①消耗液体E的质量②样品的摩尔质量③ CuO固体减少的质量
④ C装置增加的质量⑤燃烧消耗O2的物质的量
恒温恒压下,向某可变容积的密闭容器中充入3 L A和2 L B,发生如下反应:3A(g)+2B(g)  xC(g)+yD(g),达到平衡时C的体积分数为m%,若维持温度、压强不变,将0.6 L A、0.4 L B、4 L C、0.8 L D作为起始物质充入密闭容器内,达到平衡时C的体积分数仍为m%,则x=________,y=________.
xC(g)+yD(g),达到平衡时C的体积分数为m%,若维持温度、压强不变,将0.6 L A、0.4 L B、4 L C、0.8 L D作为起始物质充入密闭容器内,达到平衡时C的体积分数仍为m%,则x=________,y=________.