实验室制取氯气可以有以下途径,用化学方程式表示如下。若制取等质量的氯气,消耗盐酸最少的是( )
| A.8HCl+K2Cr2O7==2KCl+Cr2O3+4H2O+3Cl2↑ |
| B.16HCl+2KMnO4==2MnCl2+8H2O+2KCl+5Cl2↑ |
| C.4HCl+MnO2△MnCl2+2H2O+Cl2↑ |
| D.6HCl+KClO3==KCl+3H2O+3Cl2↑ |
下列有关电化学原理的说法中,错误的是
| A.在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 |
| B.在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极 |
| C.氯碱工业,主要依托电解熔融的氯化钠来制取工业上重要的化工原料烧碱和氯气 |
| D.可充电的电池称“二次电池”,在充电时,是将电能转变成化学能,在放电时,又将化学能转化成电能 |
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是Ni(OH)2 + M =" NiOOH" + MH
已知:6NiOOH + NH3 + H2O + OH-="6" Ni(OH)2 + NO2- 下列说法正确的是
| A.电池放电过程中,正极电极反应式为:NiOOH + H2O + e-= Ni(OH)2 + OH- |
| B.充电过程中阴极的电极反应式:H2O + M + e-="MH" + OH-,H2O中的H被M还原 |
| C.充电过程中OH-离子从阳极向阴极迁移 |
| D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 |
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42﹣═2PbSO4+2H2O.下列有关说法正确的是
| A.K与N相接时,能量由电能转化为化学能 |
| B.K与N相接时,Pb上发生反应为:Pb-2e- = Pb2+ |
| C.K与M连接时,所用电源的a极为负极 |
| D.K与M连接时,PbO2上发生反应为:PbO2+4e_+4H++SO42﹣═PbSO4+2H2O |
下图两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是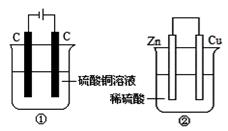
| A.产生气体体积 ①=② |
| B.①中阴极质量增加,②中正极质量减小 |
| C.溶液的pH变化:①减小,②增大 |
| D.电极反应式①中阳极:4OH- - 4e- =2H2O+O2↑, |
②中负极:2H++2e-=H2↑
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙(其pH变色范围为3.1~4.4)作指示剂,下列操作中可能使测定结果偏低的是
| A.酸式滴定管在装酸液前未用标准盐酸润洗2~3次 |
| B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 |
| C.锥形瓶溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 |
| D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 |