(10分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+ Na+ Cu2+ Al3+ |
| 阴离子 |
SO42— HCO3— NO3— OH— |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生
白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B ,D 。
(2)将含1molA的溶液与含1molE的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
(3)在A溶液中加少入量澄清石灰水,其离子方程式为 。
(4)C常用作净水剂,用离子方程式表示其净水原理 。
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)铟与镓同是IIIA族元素,写出铟基态原子的电子排布式: 。
(2)硒为第四周期VI A族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为 (用元素符号表示)。SeO3分子的立体构型为 。
(3)硅烷(SinH2n+2)的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是 。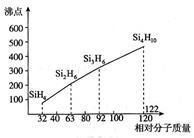
(4)硼元素具有缺电子性,其化合物往往具有加合性,如硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-,其中B原子的杂化类型为 。
(5)金属铜投入氨水中或投入H2O2溶液中均无明显现象,但投入氨水—过氧化氢混合液中,则铜片溶解,溶液呈深蓝色,写出该反应的离子方程式: 。
(6)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为 ;若该晶体的晶胞参数为a pm,则该合金密度为 g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下:
试回答下列问题:
(1)滤液X中含有的金属阳离子是______________(填离子符号)。
(2)步骤Ⅲ中可选用________调节溶液的pH(填字母)。
| A.稀硫酸 | B.氨水 |
| C.氢氧化钠溶液 | D.高锰酸钾溶液 |
(3)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是______________。
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是__________________________。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为_________________________。
一氧化碳是一种用途广泛的化工基础原料。
(l)在高温下CO可将SO2还原为单质硫。已知:2CO(g)+O2(g) 2CO2(g) △H1=-566.0kJ·mol-1;S(s)+O2(g)
2CO2(g) △H1=-566.0kJ·mol-1;S(s)+O2(g) SO2(g) △H2=-296.0kJ·mol-1;
SO2(g) △H2=-296.0kJ·mol-1;
请写出CO还原SO2的热化学方程式______________________。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图: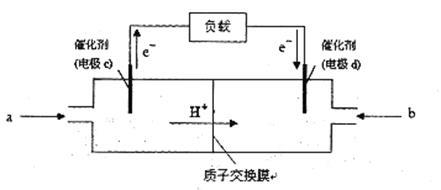
电池总反应为:2CH3OH+3O2=2CO2+4H2O,则c电极是 (填“正极”或“负极”),c电极的反应方程式为 。若用该电池电解精炼铜(杂质含有Ag和Fe),粗铜应该接此电源的________极(填“c”或“d”),反应过程中析出精铜64g,则上述CH3OH燃料电池,消耗的O2在标况下的体积为 L。
食品安全一直是社会关注的话题.过氧化苯甲酰(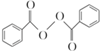 )过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图:
)过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图: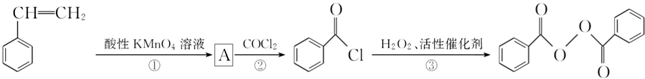 苯乙烯
苯乙烯
请回答下列问题:
(1)写出反应③的化学方程式:___________;过氧化苯甲酰在酸性条件下水解的化学方程式为________;
(2)下列有关苯乙烯的说法正确的是__________(填字母序号);
a.苯乙烯能使溴水褪色
b.苯乙烯存在一种同分异构体,其一氯代物仅有一种
c.苯乙烯分子中8个碳原子可能共平面
d.苯乙烯、庚烷燃烧耗氧量肯定相等
(3)苯甲酰氯(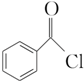 )能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称________________;
)能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称________________;
(4)写出一个符合下列要求的过氧化苯甲酰的同分异构体的结构简式________________;
①分子中不含碳碳双键或叁键;②分子中只含有一种含氧官能团;③核磁共振氢谱有3组峰,其峰面积之比为1:2:2
下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。
(1)甲同学利用如图1所示装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质。装置①用于实验室制备NH3,用装置②制备过量O2.装置①中发生反应的化学方程式是__________________________;B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请写出有关反应的化学方程式_________________________;
(2)SO3常温下是液体,16.8℃以下是无色或白色晶体。乙同学利用此套装置合成SO3,其反应为2SO2+O2 2SO3,B处冰水冷却的U型管中的固体出现.C中若盛放K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是_________________________;(生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进_________________________(从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明)
2SO3,B处冰水冷却的U型管中的固体出现.C中若盛放K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是_________________________;(生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进_________________________(从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明)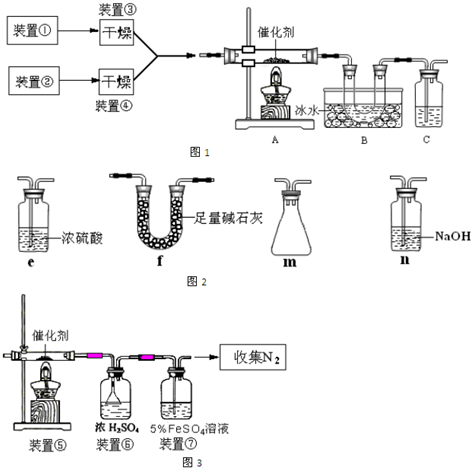
(3)丙同学采用图3所示装置拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。
请回答:装置⑦的作用可能是__________________________;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2L N2,则NO的转化率(转化率=已转化的量/原来的总量)是______________(能正确表达出计算过程即可)。