现有下列短周期元素性质的数据:
| 元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
| 原子半径 |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
| 最高化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
| 最低化合物 |
-2 |
|
|
-3 |
-1 |
|
-3 |
下列说法正确的是( )
A. 第一电离能:① > ⑦ B. 电负性:② < ④
C. 相应离子的半径: ② >⑥> ①
D. 气态氢化物的稳定性和沸点:⑦﹤④
(多选)甲、乙两烧杯中分别装有相同体积、相同 的氨水和 溶液,各加入10 0.1 溶液,两烧杯中都有沉淀生成。下列判断正确的是
| A. | 甲中沉淀一定比乙中的多 | B. | 甲  中沉淀可能比乙中的多 中沉淀可能比乙中的多 |
| C. | 甲中沉淀一定比乙中的少 | D. | 甲中和乙中的沉淀可能一样多 |
下面关于SiO2晶体网状结构的叙述正确的是
| A.存在四面体结构单元,O处于中心,Si处于4个顶角 |
| B.最小的环上,有3个Si原子和3个O原子 |
| C.最小的环上,Si和O原子数之比为1:2 |
| D.最小的环上,有6个Si原子和6个O原子 |
一定条件下磷与干燥氯气反应,若0.25g磷消耗掉314mL氯气(标准状况),则产物中PCl3与PCl5的物质的量之比接近于
| A.1:2 | B.2:3 | C.3:1 | D.5:3 |
下图表示4—溴环己烯所发生的4个不同反应。其中,产物只含有一种官能团的反应是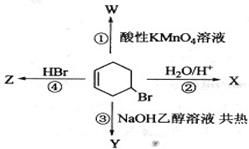
| A.①④ | B.③④ | C.②③ | D.①② |
右图是一种染料敏化太阳能电池的示意图。电池的一个点极由有机光敏燃料(S)涂覆在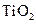 纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为: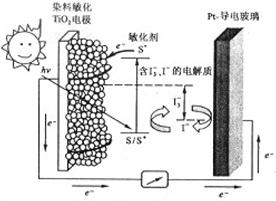
 (激发态)
(激发态)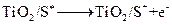
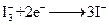
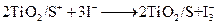
下列关于该电池叙述错误的是:
| A.电池工作时,是将太阳能转化为电能 |
B.电池工作时,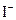 离子在镀铂导电玻璃电极上放电 离子在镀铂导电玻璃电极上放电 |
| C.电池中镀铂导电玻璃为正极 |
| D.电池的电解质溶液中I-和I3-的浓度不会减少 |