溴被称为“海洋元素”。已知Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。实验室模拟从海水中提取溴的主要步骤为:
步骤1:将海水蒸发浓缩除去粗盐;
步骤2:将除去粗盐后的母液酸化后,通入适量的氯气,使Br-转化为Br2;
步骤3:向步骤2所得的水溶液中通入热空气或水蒸气,将溴单质吹入盛有二氧化硫水溶液的容器中;
步骤4:再向该容器中通入适量的氯气,使Br-转化为Br2;
步骤5:用四氯化碳萃取溴单质,经分液、蒸馏得粗溴。
(1)步骤3中的反应的离子方程式 ▲ 。
(2)步骤2中已经制得了溴,还要进行步骤3和步骤4的原因是 ▲ 。
(3)步骤5中萃取和分液所需要的主要玻璃仪器为 ▲ 。 (4)用如上图所示的实验装置可精制粗溴。
(4)用如上图所示的实验装置可精制粗溴。

 ①反应过程中需要对A容器加热,加热的方法是 ▲ 。
①反应过程中需要对A容器加热,加热的方法是 ▲ 。
图中冷却水应从B的 ▲ 口进入(填“a”或“b”)。
②C中加冰的目的是 ▲ 。
在上海召开的第七届全球人类基因大会上,我国科学家第一次提出可以用砒霜(As2O3)来治疗早期幼粒白血病。(本题共7分)
(1)完成并配平下列化学方程式:
As2O3+ Zn+ H2SO4→ AsH3+ZnSO4+______
(2)As2O3在上述反应中显示出来的性质是_____________。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
(3)若生成0.1 mol AsH3,则转移电子的物质的量为___________mol。
已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:(本题共14分)
① A + B→白色沉淀,加入稀硝酸,沉淀不溶解
② B + D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色
③ C + D→白色沉淀,继续加入D溶液,白色沉淀逐渐消失
⑴试推断A是B是C是 D是。
⑵写出下列反应的离子方程式
A溶液 + B溶液→白色沉淀 ,
,
C溶液与D溶液反应后生成的白色沉淀溶解于D溶液中
。
实验室里用固体烧碱配制500mL0.12mol/L的NaOH溶液。(本题共11分)
⑴.需称取g的固体烧碱,为防止发生因潮解而沾粘,固体应放在中
然后置于托盘天平上称量。
⑵.配制过程中 要用到的仪器有。(写出四种即可)
要用到的仪器有。(写出四种即可)
⑶.在容量瓶内确定溶液体积的过程中,完成后期加入少量水的操作是_____
_________________________________。
⑷.如所得NaOH溶液的密度为1.2g/cm3,则 该溶液中NaOH的质量分数是。
该溶液中NaOH的质量分数是。
⑸.下列各项中,可能导致实际浓度偏高的是。(填标号)
| A.在托盘天平上垫纸,将NaOH放在纸上称量。 |
| B.NaOH溶解是会放出大量的热,未等冷却就立即配制溶液 |
| C.NaOH溶液转移到容量瓶后,溶解NaOH的烧杯和玻璃棒未洗涤 |
| D.NaOH溶液转移到容量瓶的过程中不慎洒出 |
有A、B、C、D、E五种短周期主族元素,其元素特征信息如下表:
| 元素编号 |
元素特征信息 |
| A |
其单质是密度最小的物质 |
| B |
阴离子带有两个单位的负电荷,单质是空气的主要成分之一 |
| C |
其阳离子与B的阴离子具有相同的电子层结构,且核电荷数与B相差 3 3 |
| D |
与C同周期,且最外层电子是C的3倍 |
| E |
与D同周期,原子半径在该周期中最小 |
请回答下列问题:
(1) 写出A、B、C三种元素形成的化合物的化学式为。
(2) B、C、D的简单离子半径由大到小的顺序是(用离子符号表示)。
(3 )写出电解CE溶液的化学方程式:
)写出电解CE溶液的化学方程式:
。( 本题共7分)
本题共7分)
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。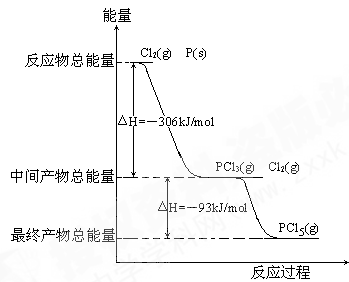
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式__ ____________________________。
____________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式______________________________,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1[分解率即分解量除起始量]等于_____ ____;。
(3)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_____________。