化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种。且均符合勒夏特列原理。请回答下列问题。
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g) 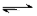 4C(g)
4C(g)  H >0 达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是 ;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是
H >0 达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是 ;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是
①增加C的物质的量 ②加 压 ③升温 ④使用催化剂
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1 m2(选填“<”、“=”、“>”)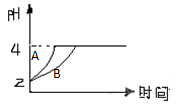
有一个食品广告称:“我公司生产的新型糕点不含糖,是糖尿病人的最佳选择”。下表是其包装袋上的说明,从表中的配料中分别选出一种物质填在相应的横线上。
| 品名 |
XXX |
| 配料 |
鲜鸡蛋、精面粉、精炼植物油、碳酸氢钠、甜蜜素、柠檬黄、苯甲酸钠等 |
| 保质期 |
120天 |
| 生产日期 |
标于包装袋封口上 |
(1)富含蛋白质的是________;
(2)富含油脂的是________;
(3)属于防腐剂的是________;
(4)属于着色剂的是________;
(5)属于调味剂的是________;
(6)属于疏松剂的是________;
(7)请分析广告的说法是否科学?____________________________________。
色香味俱佳、口感好的食品深受人们的喜爱。为了提高食品的质量,在生产过程中往往会加入一些能改变食品某些性质的物质(即食品添加剂)。
(1)味精是常用的一种鲜味剂,其有效成分是谷氨酸钠,它的结构简式是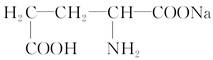 ,该物质分子中所含的官能团有________和________(填写名称)。
,该物质分子中所含的官能团有________和________(填写名称)。
(2)碳酸氢钠是常见的疏松剂,主要是因为它在加热条件下产生了气体,使食品变得疏松。试写出碳酸氢钠受热分解的化学方程式:__________________________________。
据中央电视台新闻报道,某知名品牌保健食品补钙剂经检测,H2O2含量超标,试回答下列问题.
(1)该品牌保健食品属于________的保健食品。
A.强化营养人群
B.特殊人群
C.健康异常人群
(2)试推测该保健食品中钙以________的方式存在。
A.钙单质B.Ca(OH)2 C.CaCO3D.乳酸钙
(3)试写出超标的H2O2的电子式________。
(4)某成年女子,经化验知缺铁,如果该女子也使用补铁保健食品,能否与该品牌保健食品同时食用________,如果不能,试用化学方程式表示其原因__________________________。
某种甜味剂A的甜度是蔗糖的200倍,由于它热值低、口感好、副作用小,已在90多个国家广泛使用。A的结构简式为: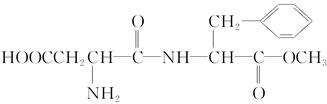
已知:①在一定条件下,羧酸酯或羧酸与含—NH2的化合物反应可以生成酰胺,如: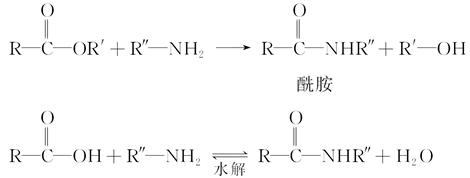
②酯比酰胺容易水解。请填写下列空白:
(1)在稀酸条件下加热,化合物A首先生成的水解产物是________和________。
(2)在较浓酸和长时间加热条件下,化合物A可以水解生成________、________和________。
(3)化合物A分子内的官能团之间也可以发生反应,再生成一个酰胺键,产物是甲醇和________________。(填写结构简式,该分子中除苯环以外,还含有一个六原子组成的环)。
某有机物含碳、氢、氧、氮四种元素。如图是该有机物的球棍模型(其中黑点表示原子,短线表示原子之间的共价键),则该有机物的化学式为________________________。
写出该有机物的一种同分异构体,它的分子中含有两个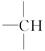 ,且是天然蛋白质水解的最终产物之一,则该同分异构体的结构简式为_____________________________________。
,且是天然蛋白质水解的最终产物之一,则该同分异构体的结构简式为_____________________________________。