溴被称为“海洋元素”。已知Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。实验室模拟从海水中提取溴的主要步骤为:
步骤1:将海水蒸发浓缩除去粗盐
步骤2:将除去粗盐后的母液酸化后,通入适量的氯气,使Br-转化为Br2。
步骤3:向步骤2所得水溶液中通入热空气或水蒸气,将溴单质吹入盛有二氧化硫水溶液的容器中
步骤4:再向该容器中通入适量的氯气,使Br-转化为Br2
步骤5:用四氯化碳萃取溴单质,经分液、蒸馏得粗溴。
(1)步骤3中的反应的离子方程式 。
(2)步骤2中已经制得了溴,还要进行步骤3和步骤4的原因是 溴元素。
(3)步骤5中萃取和分液所需要的主要玻璃仪器为 。 (4)可用下图实验装置精制粗溴。
(4)可用下图实验装置精制粗溴。

 ①反应过程中需要对A容器加热,加热的方法是 。
①反应过程中需要对A容器加热,加热的方法是 。
图中冷却水应从B的 口进入(填“a”或“b”) 。
②C中加冰的目的是 。
(15分)氯化亚铜是重要的铜盐系列化工产品,广泛应用于石油化工、纺织印染、颜料、医药、电镀、有机合成等行业。以工业海绵铜为原料,采用硝酸铵氧化分解技术生产硫酸铜进而生产氯化亚铜。海绵铜的主要成分是CuO和Cu,生产工艺流程图如下。
思考并回答下列问题。
(1)生产原理:
①溶解时生成的还原产物在酸性溶液中稳定存在,请写出此时的氧化还原反应离子方程式 。
②还原氯化:2CuSO4 + (NH4)2SO3 + 2NH4Cl + H2O ="=" 2CuCl↓ + 2(NH4)2SO4 + H2SO4
(2)得到副产品的化学式为 。
(3)生产后阶段,从滤液获得副产品的步骤:①蒸发浓缩 ②冷却结晶 ③ ④洗涤 ⑤干燥。
(4)产品的洗涤方法是,先用pH=2的稀H2SO4洗,后用95%的酒精洗。酒精洗的目的是 ;请设计简单实验方案,检验稀H2SO4洗时是否洗干净 。
(5)定量分析
称取2.000g CuCl样品(杂质不参与反应),溶于一定量的0.5000mol·L-1FeCl3溶液中,加水稀释至200mL得到溶液,取20.00mL 用0.1000mol·L-1的Ce(SO4)2溶液滴定到终点,消耗20.00mLCe(SO4)2溶液。
①此实验涉及溶液配制与定量滴定的基本操作中,合理的是 ;
②有关反应式:Fe3++CuCl=Fe2++Cu2++Cl- Ce4++Fe2+=Fe3++Ce3+
则样品中CuCl的质量分数 。
(14分)某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回答下列问题:
(1)按上图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器b的名称为________;实验过程中,装置B中观察的现象是_______________;装置C中有白色沉淀生成,该沉淀是______________(填化学式),原因是___________。
(2)装置A中还会产生CO2气体,请写出产生CO2的化学方程式:______________________。
(3)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置连接A装置中c处管口,从左到右的顺序为 (填序号);装置②的作用是 ;③的作用是 ;然后再进行的操作是从a处多次鼓入N2,原因是_______________。
(4)某同学通过验证实验后期装置A中产生的气体中还含有H2,理由是________(用离子方程式表示)。
选考【化学——选修2化学与技术】粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物组成为SiO2、Al2O3、CaO等。 一种利用粉煤灰制取氧化铝的工艺流程如下: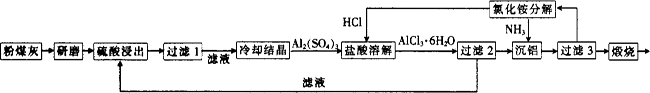
(1)粉煤灰研磨的目的是 。
(2)第1次过滤时滤渣的主要成分有 (填化学式,下同)和 ,第3次过滤时滤渣的成分是 。
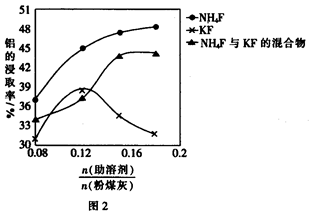
(3)在104℃用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为 h;铝的浸取率与 的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在
的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在 相同时,浸取率最高的是 (填化学式);用含氟的化合物作这种助溶剂的缺点
相同时,浸取率最高的是 (填化学式);用含氟的化合物作这种助溶剂的缺点
是 (举一例)。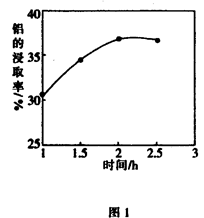
(4)流程中循环使用的物质有_____和_____。(填化学式)
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出AlCl3·6H2O,该过程能够发生的原因是 。
(6)用粉煤灰制取含铝化合物的主要意义是 。
某化学活动小组按下图所示流程由粗氧化铜样品(含少量氧化亚铁及不溶于酸的杂质)制取无水硫酸铜。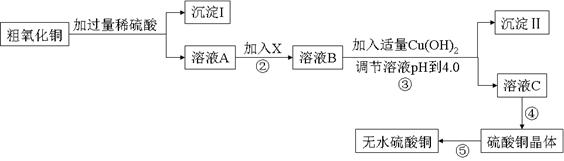
已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示: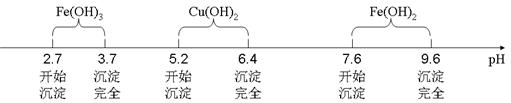
请回答下列问题:
(1)在整个实验过程中,下列实验装置不可能用到的是 (填序号)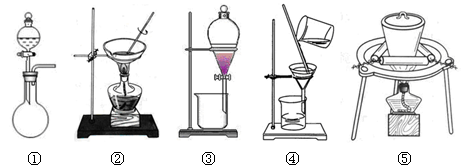
(2)溶液A中所含溶质为 ;物质X应选用 (填序号)
①氯水②双氧水 ③铁粉 ④高锰酸钾
(3)从溶液C中制取硫酸铜晶体的实验操作为 。
(4)用“间接碘量法”可以测定溶液A中Cu2+(不含能与I-发生反应的杂质)的浓度。过程如下:
第一步:移取10.00mL溶液A于100mL容量瓶,加水定容至100mL。
第二步:取稀释后试液20.00mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质。
第三步:以淀粉溶液为指示剂,用0.05000mol·L-1的Na2S2O3标准溶液滴定,前后共测定三组。达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:(已知:I2+2S2O32-=2I-+S4O62-)
| 滴定次数 |
第一次 |
第二次 |
第三次 |
| 滴定前读数(mL) |
0.10 |
0.36 |
1.10 |
| 滴定滴定后读数(mL) |
20.12 |
20.34 |
22.12 |
①CuSO4溶液与KI的反应的离子方程式为 。
②滴定中,试液Na2S2O3应放在 (填“酸式滴定管”或“碱式滴定管”),滴定终点的现象是 。
③溶液A中c(Cu2+)= mol/L。
硫酸锰在工业上广泛用于制电解猛、合成脂肪酸催化剂等。某科研小组利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰晶体,其工艺流程如下: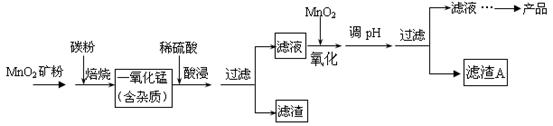
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
| pH |
5.2 |
3.2 |
9.7 |
10.4 |
已知溶液的pH大于9时氢氧化铝又开始溶解。
请回答下列问题:
(1)焙烧时一般需要把矿石粉碎,矿石粉碎的目的是_______________;高温焙烧时在实验室宜选择的主要仪器是______________。
(2)酸浸、过滤后再向滤液中加入MnO2的目的是将溶液中的Fe2+氧化成Fe3+,该反应的离子方程式为 。
(3)在氧化的同时需要调节溶液的pH值,应调节pH的范围为 。滤渣A的成分除MnO2外,还有_______________。
(4)滤液得到产品的实验操作步骤为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。检验产品已洗涤干净的实验操作为______________________________。
(5)工业生产中为了确定需要向滤液中加入多少MnO2粉末,可准确量取10.00mL滤液用0.02mol/L酸性KMnO4溶液滴定,判断滴定终点的方法是 ;若达滴定终点共消耗10.00mL酸性KMnO4溶液,则滤液中Fe2+浓度是______________。
(6)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式为:
__________________________________。