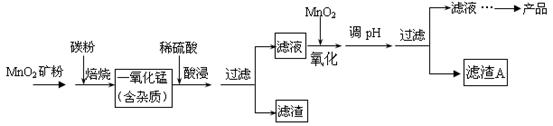
硫酸锰在工业上广泛用于制电解猛、合成脂肪酸催化剂等。某科研小组利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰晶体,其工艺流程如下:
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
| pH |
5.2 |
3.2 |
9.7 |
10.4 |
已知溶液的pH大于9时氢氧化铝又开始溶解。
请回答下列问题:
(1)焙烧时一般需要把矿石粉碎,矿石粉碎的目的是_______________;高温焙烧时在实验室宜选择的主要仪器是______________。
(2)酸浸、过滤后再向滤液中加入MnO2的目的是将溶液中的Fe2+氧化成Fe3+,该反应的离子方程式为 。
(3)在氧化的同时需要调节溶液的pH值,应调节pH的范围为 。滤渣A的成分除MnO2外,还有_______________。
(4)滤液得到产品的实验操作步骤为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。检验产品已洗涤干净的实验操作为______________________________。
(5)工业生产中为了确定需要向滤液中加入多少MnO2粉末,可准确量取10.00mL滤液用0.02mol/L酸性KMnO4溶液滴定,判断滴定终点的方法是 ;若达滴定终点共消耗10.00mL酸性KMnO4溶液,则滤液中Fe2+浓度是______________。
(6)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式为:
__________________________________。
实验室用燃烧法测定某种a一氨基酸X(CXHYOZNP)的分子组成。取1.67 g X放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图所示装置进行实验(铁架台、铁夹、酒精灯等未画出),请回答有关问题:
(1)实验开始时,首先打开止水夹a,关闭止水夹b,通一段时间的纯氧,这样做的目的是
。
(2)以上装置中需要加热的有(填装置代号) 。操作时应先点燃处的酒精灯。
(3)配平装置A中发生反应的化学方程式
CXHYOZNP+O2→CO2+H2O+N2
(4)装置D的作用是。
(5)实验结果:
①B中浓硫酸增重0.81 g,C中碱石灰增重3.52 g,F中收集到112 mL(标准状况)气体。
②x的相对分子质量为167,试通过计算确定该有机物X的分子式。
下表是稀硫酸与某金属反应的实验数据:
| 实验序号 |
金属 质量/g |
金属状态 |
c(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/s |
|
| 反应前 |
反应后 |
||||||
| 1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
| 2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
| 3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
| 4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
| 5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
| 6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
| 7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
| 8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
| 9 |
0.10 |
丝 |
1.1 |
50 |
30 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,_________对反应速率有影响,_________反应速率越快,能表明同一规律的实验还有_________(填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有_________(填实验序号);
(3)本实验中影响反应速率的其他因素还有_________,其实验序号是_________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
____________________________________。
实验室用下图装置制取少量溴苯,试填写下列空白。
(1).在烧瓶a中装的试剂是、、。
(2).请你推测长直导管b的作用: ___________ 。
(3).请你分析导管c的下口不能浸没于液面中的原因是
。
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有褐色难溶于水的液体,简述获得纯净的溴苯应进行的实验操作:____________________________。
我校某化学小组欲设计实验检验浓H2SO4和木炭反应的所有产物:
(1)写出浓H2SO4和木炭反应的化学方程式
(2)请你从下图中选用所需的仪器(可重复使用)组成一套装置帮助该小组实现他们的目的.现提供浓H2SO4、木炭和酸性KMnO4溶液,无水硫酸铜,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
将所选的仪器按连接顺序由上至下依次填入下表(可以不填满,也可以补充),并写出该仪器中应加试剂的名称及其作用。
| 选用的仪器 (填字母) |
加入的试剂 |
作用 |
| (1) |
无水硫酸铜 |
|
| (2) A |
||
| (3) |
酸性KMnO4溶液 |
|
| (4) |
检验SO2是否已除尽 |
|
| (5) A |
(10分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用带刻度的集气瓶排水法收集氢气,每隔1分钟记录一次数据(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)从0~3分钟时间段内,产生氢气的速率是如何变化的?答:___________________,造成这种变化的主要因素是____________;从3~5分钟时间段内,产生氢气的速率是如何变化的?
答:_________________,造成这种变化的主要因素是_________________。
(2)在盐酸中分别加入等体积的下列溶液,能减缓反应速率而又不减少产生氢气的量的是__________(双选题,漏选得1分,多选错选得0分)。
A.蒸馏水 B.CuSO4溶液 C.Na2CO3溶液 D.NaCl溶液
(3)在0~1、1~2、2~3、3~4、4~5分钟五个时间段中,反应速率最大的是在分钟时间段内,在该时间段内盐酸的反应速率为mol·L-1 min-1(设溶液体积不变,上述气体体积为标况下数据)。