我校某化学小组欲设计实验检验浓H2SO4和木炭反应的所有产物:
(1)写出浓H2SO4和木炭反应的化学方程式
(2)请你从下图中选用所需的仪器(可重复使用)组成一套装置帮助该小组实现他们的目的.现提供浓H2SO4、木炭和酸性KMnO4溶液,无水硫酸铜,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
将所选的仪器按连接顺序由上至下依次填入下表(可以不填满,也可以补充),并写出该仪器中应加试剂的名称及其作用。
| 选用的仪器 (填字母) |
加入的试剂 |
作用 |
| (1) |
无水硫酸铜 |
|
| (2) A |
|
|
| (3) |
酸性KMnO4溶液 |
|
| (4) |
|
检验SO2是否已除尽 |
| (5) A |
|
|
某同学设计实验以探究元素性质的递变规律,实验装置如图所示。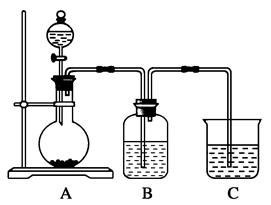
实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。
已知A装置的烧瓶里装有大理石,分液漏斗里装有稀HNO3,B装置中装有饱和碳酸氢钠溶液,装置C中装有Na2SiO3溶液,试回答:
(1)A中反应的离子方程式为____________________,C中可观察到的现象是________。
(2)B装置的作用是__________________________________________________________。
(3)根据实验现象推知,碳酸、硝酸、硅酸的酸性强弱顺序是________,由此得出碳、硅、氮三种元素非金属性的强弱顺序是________。
实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯和溴元素的非金属性强弱。
(4)写出B装置中发生反应的离子方程式:_______________________________________。
(5)C装置的作用是_________________________________________________________。
(6)实验结论:氧化性:____________________,非金属性:____________________。
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。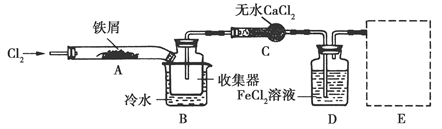
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为______________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)________。
(4)装置B中冷水浴的作用为________;装置C的名称为________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:________。
(5)在虚线框中画出尾气吸收装置E并注明试剂。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为________________。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为____________________。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;②________________。
某学生在做元素性质与原子结构的关系的实验时,设计了一套实验方案,并记录了有关的实验现象。请帮助该学生整理并完成实验报告。
(1)实验目的。
探究同一主族元素性质的递变规律。
(2)实验用品。
仪器:试管、胶头滴管。
药品:新制氯水、新制溴水、溴化钠溶液、碘化钠溶液、四氯化碳。
(3)实验内容(在下表横线中填写相关内容)。
| 序号 |
实验方案 |
实验现象 |
| ① |
向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 |
液体分为两层,下层呈________色 |
| ② |
向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 |
液体分为两层,下层呈________色 |
(4)实验结论:__________________________________________________________。
(5)问题和讨论。
①上述两个实验中发生反应的离子方程式分别为________、________。
②由于氟单质过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯的强:________、________。
甲同学欲配制100 mL 3.6 mol/L的稀硫酸。
(1)若采用18 mol/L的浓硫酸配制该溶液,需要浓硫酸的体积为________mL;所选用容量瓶的规格为________mL。
(2)甲同学的配制步骤:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶中加水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①洗涤操作中,将洗涤烧杯后的溶液也注入容量瓶,其目的是________。
②定容的正确操作是继续加蒸馏水至离刻度线下________时,改用________加水至液面与刻度线相切。
③用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是________(填字母序号,下同)。
A.吸出多余液体,使凹液面与刻度线相切
B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的浓硫酸
D.重新配制
(3)配制时下列操作会导致所配溶液浓度偏高的是________。
A.转移时有少量溶液溅出
B.定容时俯视读取刻度
C.容量瓶用蒸馏水洗净后未干燥
D.定容时液面超过了刻度线
某研究性学习小组的同学通过课外学习了解到:某品牌牙膏中含有摩擦剂、湿润剂、表面活性剂、黏合剂、香料、甜味剂等成分,其中的摩擦剂除了含CaCO3外,可能还含有Al(OH)3、SiO2中的一种或两种。为探究该品牌牙膏中摩擦剂的成分,该小组的同学进行了如下实验(牙膏中其他成分遇到盐酸时无气体产生):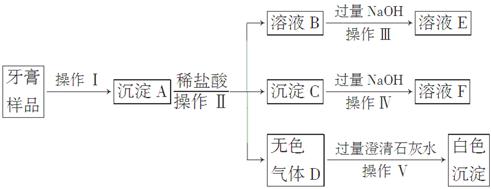
请回答下列问题:
(1)操作Ⅰ中涉及的玻璃仪器有烧杯、________、________。
(2)写出下列操作过程涉及的离子方程式:
操作Ⅲ:______________________________,
操作Ⅳ:______________________________。
(3)该摩擦剂中除CaCO3外,肯定含有__________________。
(4)为进一步探究摩擦剂中碳酸钙的含量,该小组同学利用如图所示装置(图中夹持仪器略去)进行实验。
请回答下列问题:
①实验过程中需持续缓缓通入空气。其作用除了可充分混合装置乙和丙中的反应物外,还有________的作用;
②丙中主要反应的化学方程式是________________;
③实验中准确称取4.00 g样品三份,进行三次测定,测得BaCO3的平均质量为1.97 g,计算样品中碳酸钙的质量分数(要求有计算过程):__________________________;
④有同学认为只要测定装置丙在吸收CO2前后的质量差,不必测定装置丙中生成的BaCO3质量,一样可以确定碳酸钙的质量分数。你认为该方案是否可行?________,简述理由:________。