工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理:①Al4C3与硫酸反应可生成CH4。②AlN溶于强酸产生铵盐,溶于强碱生成氨气。
(2)实验装置(如图所示):

(3)实验过程:
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL
②称取xgAlN样品置于装置B瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入稀硫酸,与装置B瓶内物质充分反应。③待反应进行完全后,关闭活塞K1,打开活塞 ,通过分液漏斗加入过量NaOH ,与装置B瓶内物质充分反应。④ (填入该步应进行的操作)。⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据分析:(已知:该实验条件下的气体摩尔体积为Vm L·mol-1)
①Al4C3的质量分数为 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”、“偏小”或“无影响”)。
③AlN的质量分数为 。
现用质量分数为98%.密度为1.84 g/ml的浓硫酸来配制500ml0.2mol/l的稀硫酸,可供选择的仪器如下;①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥容量瓶⑦托盘天平⑧药匙请回答下列问题。
(1)上述仪器中,在配制稀硫酸时用不到的仪器有(填序号)
(2)经计算,需浓硫酸的体积为。现有①10ml.②50ml.③100ml三种规格的量筒,你选用的量筒是(填序号)
(3)将浓硫酸稀释后,冷却片刻,随后全部转移到ml的容量瓶中,转移时应用玻璃棒,转移完毕后,用少量蒸馏水洗涤烧杯玻璃棒2~3次,并将洗涤液也转入容量瓶中,在加适量蒸馏水直到液面接近刻线处。改用滴加蒸馏水到瓶颈刻度的地方,将溶液振荡,摇匀后,装瓶,贴签。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏高、偏低、无影响填写)
A、容量瓶用蒸馏水洗涤后未干燥_________________;
B、所用的浓硫酸长时间放置在敞口容器内_________________;
C、定容时仰视溶液的凹液面_________________;
Fe在地壳中的含量虽次于铝,但铁及其化合物在生活、生产中的应用最广泛。请回答下列问题:
(1)Na2FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备铁酸钠的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是
| A.Na2O2在反应中只作氧化剂 |
| B.Na2FeO4既是氧化物又是还原产物 |
| C.O2是还原产物 |
| D.2molFeSO4发生反应时,反应中共有8mol电子转移 |
(2)硫酸亚铁晶体(FeSO4·7H2O),俗称“绿矾”,常作医药上的补血剂。课外研究性小组测定某片状补血药品中铁元素的含量。实验步骤如下:
请回答下列问题:
①该小组发现将片状补血剂长 时间置于空气中,表面“发黄”,请用化学方程式表示原因。
时间置于空气中,表面“发黄”,请用化学方程式表示原因。
②课外研究性小组发现在滤液A中滴入少量KClO溶液,并加入适量硫酸,溶液立即变黄。
甲同学推测该反应的还原产物有两种可能:①Cl2、②Cl-
乙同学结合甲的推测,认为其中一种可能可以排除,你认为可以排除的是(填序号);用离子方程式说明理由。
③若该实验温度下,上述红褐色难溶物质的溶度积为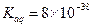 试计算该物质沉淀完全所需要的pH=(要求保留2位有效数字)(已知溶液中离子浓度小于10-5mol/L时,该离子可看做沉淀完全,lg2=0.3)
试计算该物质沉淀完全所需要的pH=(要求保留2位有效数字)(已知溶液中离子浓度小于10-5mol/L时,该离子可看做沉淀完全,lg2=0.3)
④若实验过程中无损耗,最后称量得到mg红棕色的固体,则每片补血剂中含铁元素的质量为g(用含m的式子表示)
⑤丙同学认为蒸干灼烧溶液B,也可以制得红棕色固体C,请结合化学方程式加以说明
。
某课外兴趣小组的同学向Na2SiO3溶液中滴加盐酸,预计会生成H2SiO3胶体,用激光笔照射会出现“丁达尔现象”。但令人意想不到的是,试管中在出现硅酸胶体的同时也出现了大量气泡,为什么会出现这种现象呢?甲乙两同学进行了大胆的推测。
甲同学推测是生成了硅酸胶体,造成HCl在溶液中的溶解度变小,最终从溶液中逸出;
乙同学咨询了实验员得知这瓶Na2SiO3溶液已经放置很长一段时间,他推测溶液可能已经变质,故导致以上现象的出现。
(1)请设计一个最简单的实验验证甲同学的推测是否正确:;
(2)乙同学取这瓶久置的硅酸钠溶液,用激光笔照射,发现有光柱出现,说明在这瓶硅酸钠溶液中已经有胶体生成。推测产生的气体可能是,然后乙同学又做了两个实验进行验证:
I取少量该瓶溶液,向其中滴加,并检验产生的气体。请写出检验该气体的常用方法:;
II取硅酸钠固体,配成饱和溶液,现配现用,滴入盐酸,观察现象;
通过以上实验,证明了乙同学观点,请写出所对应的化学反应方程式:
、;
该小组同学还发现按教材所述的操作方法和条件制备硅酸胶体,有时需要很长时间才能使溶胶慢慢凝聚,甚至不易形成凝胶,效果很不理想。因此,该组同学又对实验条件和操作进行探究,相关实验数据如下表:
| 硅酸钠溶液浓度 |
盐酸浓度 |
试剂加入顺序 |
出现凝胶时间(s) |
|
| 实验1 |
饱和溶液 |
1:2(盐酸和水体积比,下同) |
将Na2SiO3溶液滴加到稀盐酸中 |
21 |
| 实验2 |
稀溶液(1体积饱和溶液和3体积水混合) |
1:2 |
将稀盐酸滴加到Na2SiO3溶液中 |
38 |
| 实验3 |
饱和溶液 |
1:4 |
将Na2SiO3溶液滴加到稀盐酸中 |
10 |
| 实验4 |
稀溶液(1体积饱和溶液和3体积水混合) |
1:4 |
将稀盐酸滴加到Na2SiO3溶液中 |
50 |
该组部分同学通过实验得出结论:使用饱和Na2SiO3溶液和稀盐酸,将Na2SiO3溶液滴加到稀盐酸中效果较好。但该组另外一部分同学认为基于限定的条件,该探究实验设计组数不够,不能保证结论的准确性,要使实验具有说服力至少要做组实验。
已知某酸性土壤浸取液中除Fe3+外,还含有一定量Mg2+和Al3+。请设计合理实验检验该浸取液中的Mg2+、Al3+。
限选实验用品与试剂:烧杯、试管、玻璃棒、滴管、玻璃片、pH试纸;浸取液、20%KSCN、0.1 mol·L-1NaOH、6 mol·L-1NaOH、0.1 mol·L-1HCl、蒸馏水。
必要时可参考:
| 沉淀物 |
开始沉淀时的pH |
沉淀完全时的pH |
| Mg(OH)2 |
9.6 |
11.1 |
| Fe(OH)3 |
2.7 |
3.7 |
根据你设计的实验方案,叙述实验操作、预期现象和结论。(测定溶液pH的具体操作可不写)
| 实验操作 |
预期现象和结论 |
| 步骤1: |
|
| 步骤2: |
|
| 步骤3: |
|
| …… |
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为::;
为了吸收该反应中产生的尾气,请选择下列中合适的装置。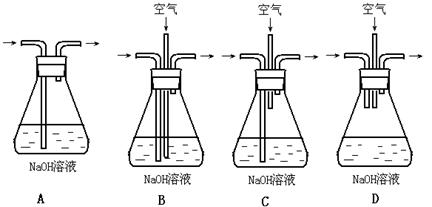
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
如开始加入的铜粉为3.2 g,最后所得溶液为500 mL,溶液中含有铁元素0.005 mol。①方案1中的B仪器名称是。
②为了使铁元素全部沉淀,应调节pH至少为_________。
③方案2中甲物质可选用的是。
| A.CaO | B.NaOH | C.CuCO3 | D.Cu2(OH)2CO3 E、Fe2(SO4)3 |
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因。
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5g。
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是,
⑥本实验CuSO4·5H2O的产率为。