下表是稀硫酸与某金属反应的实验数据:
| 实验序号 |
金属 质量/g |
金属状态 |
c(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/s |
|
| 反应前 |
反应后 |
||||||
| 1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
| 2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
| 3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
| 4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
| 5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
| 6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
| 7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
| 8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
| 9 |
0.10 |
丝 |
1.1 |
50 |
30 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,_________对反应速率有影响,_________ 反应速率越快,能表明同一规律的实验还有_________(填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有_________(填实验序号);
(3)本实验中影响反应速率的其他因素还有_________ ,其实验序号是_________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
____________________________________。
(Ⅰ)用质量分数为98%的浓硫酸(密度为1.84g/cm3)配制成1mol/L的稀硫酸.现实验室仅需要这种硫酸220mL.试回答下列问题:
(1)配制稀硫酸时,应选用容量为________mL的容量瓶;
(2)经计算需要用量筒量取_______mL浓硫酸,在量取时宜选用下列量筒中的____(填字母).
| A.5mL | B.10mL | C.25mL | D.50mL |
(3)在量取浓硫酸后,进行了下列操作:
①等稀释的硫酸其温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近环形标线1-2cm处,改用胶头滴管加蒸馏水,使溶液的凹液面底部与瓶颈的环形标线相切。
③将浓硫酸缓缓注入盛适量蒸馏水的烧杯中,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)________________。
(4)容量瓶使用之前,检查其是否漏水的具体操作为
。
(5)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓硫酸,其配制的稀硫酸浓度会________(填“偏高”、“偏低”、“无影响”)。
(Ⅱ)某同学称量mgNaOH固体配制V m L 4mol/L的NaOH溶液,下面是该同学配制过程的示意图,其操作中错误的是(填操作序号)。
某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质______、_______。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:
B ,
D。
(3)装置C的作用是。
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是
,
反应的离子方程式是;
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?
。
瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: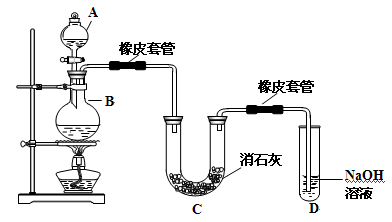
(1)A仪器的名称是 ,所盛试剂是。
(2)漂白粉将在U形管中产生,其化学方程式是。
(3)此实验结果所得Ca(ClO)2产率太低。经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
① 温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是 。
② 试判断另一个副反应(写出此反应方程式): 。
(4)2005年以来,淮安、无锡等地发生重大液氯泄漏事故。某城市以“液氯泄漏”作为应急预警演习的项目,演习时下列处理措施不合理的是(请填写序号 )。
① 人员就近向地下商场或地铁转移
② 及时用毛巾包裹活性炭捂住口鼻
③ 及时戴上用烧碱溶液湿润过的口罩
④ 液氯罐中的液氯泄漏时,可将其移入新开挖的坑塘中,并加入生石灰
实验室用2.0 mol/L NaCl溶液配制100mL 0.50 mol/L NaCl溶液。
(1)配制上述溶液,需要2.0 mol/L NaCl溶液mL。
(2)配制上述溶液除需要玻璃棒、胶头滴管外,还需要的玻璃仪器有烧杯、量筒、 __________________。20g NaOH固体溶解 后配制成100mL溶液,其溶质物质的量为,取出10mL该溶液,它的物质的量浓度为。
(3)在配制过程中,其它操作都正确,下列操作中,能引起浓度偏高的有(填代号): ①
②定容时加蒸馏水超过刻度线,又用胶头滴管吸出
②转移溶液前,容量瓶中含有少量 水
③定容摇匀后发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
④定容时,俯视刻度线
实验室用浓盐酸和二氧化锰共热制取氯气,现要制取一瓶干燥纯净的氯气,并防止剩余氯气逸出污染空气。现有下列仪器和药品可供使用:
(1)写出实验室用浓盐酸和二氧化锰制取氯气的化学反应方程式:【二氧化锰转变为氯化锰】;
(2)连接上述仪器的正确顺序是(填各接口处的字母)
A接,接,接G, H接D。
(3)气体尾气吸收装置中反应的化学方程式为。
(4)在装置中:a.饱和食盐水的作用是;
b.浓硫酸的作用是;