(18分)甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性己检验)。
实验操作和现象:
(1)A中反应的化学方程式是 。
(2)C中白色沉淀是 ,该沉淀的生成表明SO2,具有 性。
(3)C中液面上方生成浅棕色气体的化学方程式是 。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲同学认为是空气参与反应,乙同学认为
是白雾参与反应。
①为证实各自的观点,在原实验基础上/甲同学在原有操作之前增加一步操作,该操作是
;乙同学在A、B间增加洗气瓶D,D
中盛放的试剂是 。
②甲、乙两同学分别改进实验后,B装置中现象分别为:
| 甲 |
大量白色沉淀 |
| 乙 |
少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。请用离子方程式解释甲、乙两同学改进实验后仍然产生沉淀的原因,甲: ,乙: 。
(5)合并(4)中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是 。
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸
点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。
某学生拟用左下图所示装置模拟工业制取并收集ClO2。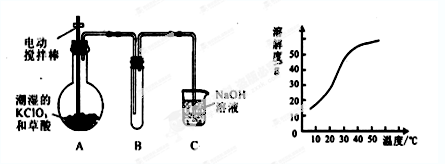
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有 、;
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据上图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①;②;③洗涤;④干燥。
(4)ClO2很不稳定,需随用随制,用水吸收得到ClO2溶液。为测定所得溶液中
ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;量取V1mL试样加入到锥
形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;此时发生的离子方程式
为:;
步骤3:加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
则原ClO2溶液的浓度为g/L(用含字母的代数式表示)。
(已知2 Na2S2O3+I2= Na2S4O6+2NaI)
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。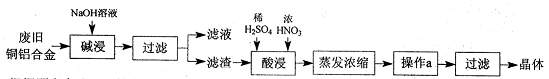
根据题意完成下列填空:
(1)“碱浸”的目的是,写出有关的离子方程式。
(2)向滤渣中先加入足量稀硫酸,然后再滴加少量浓硝酸,在废渣溶解时可以观察到的实验现象有。
(3)操作a的名称为,制得的CuSO4·5H2O中可能存在硝酸铜杂质,除去这种杂质的实验操作名称为。
(4)已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4。称取0.26 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸8.00 mL,则该试样中CuSO4·5H2O的质量分数为;上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用。
(5)在“酸浸”的步骤中,①若只加入浓硫酸,写出加热时的化学方程式。
②若将浓硝酸换成过氧化氢,常温时即可生成硫酸铜,指出此种方法的优点。
某化学研究性学习小组拟对一种焰火原料(由两种短周期的常见金属单质组成的合金粉末)进行探究。请完成下列探究报告。
【探究目的】探究该焰火原料的组成
【资料检索】①Mg2+检验方法:取2滴待检液,加入2滴2mol·L-1NaOH溶液,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+。Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+检出
②Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵
③很多合金是金属互化物,有确定的化学组成
【探究思路】①确定焰火原料所含金属种类;②测定焰火原料的化学式
【实验探究】
(1)甲同学进行了初步试验,实验步骤和实验现象如下。请填写下表。
| 试验序号 |
实验步骤 |
实 验 现象 |
结论 |
| ① |
取少量该焰火原料加入冷水 |
无明显现象 |
________________ |
| ② |
取少量该焰火原料加入稀盐酸 |
完全溶解,有大量气体 |
_________________ |
(2)乙同学取甲第②组实验的溶液,加入镁试剂(Ⅰ)染料,得出合金中不含镁。
乙的结论________________(选填“正确”或“错误”)。判断理由为
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下。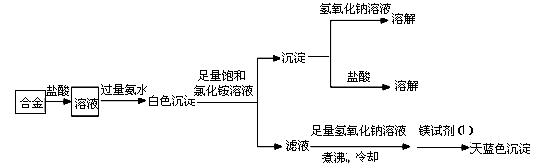
由丙的实验记录可知,该焰火原料是由_______和_________两种金属组成的合金;实验中滤液加入足量
氢氧化钠溶液后需煮沸,煮沸的理由是______________________________。
(4)丁同学利用丙同学的结论,设计如下图所示的实验步骤,确定合金组成。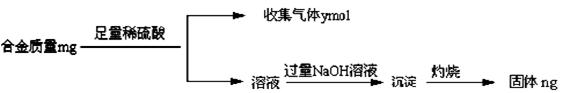
问题讨论:
①能确定合金组成的数据组有______________(填写选项字母);
A.m、n B.m、yC.n、y
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,试在下图中作出y随x变化的曲线;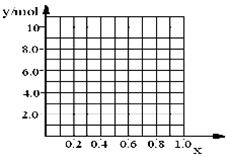
③当y=8.5mol时,该合金是一种金属互化物,其化学式为________________
海水中蕴藏着丰富的资源。海水综合利用的流程图如下。
(1)用NaCl做原料可以得到多种产品。
① 工业上由NaCl制备金属钠的化学方程式是_______________________________。
②电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:____________________________。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经过下列途径可获得金属镁:
卤水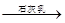 Mg(OH)2
Mg(OH)2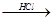 MgCl2溶液→MgCl2·6H2O→MgCl2
MgCl2溶液→MgCl2·6H2O→MgCl2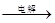 Mg
Mg
其中,由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下: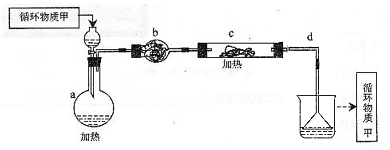
①上图中,装置a由、、双孔塞和导管组成。
②循环物质甲的名称是。
③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是。
④装置b中填充的物质可能是。
某同学欲在实验室中完成Fe与水蒸气反应的实验,装置如图甲、乙两种。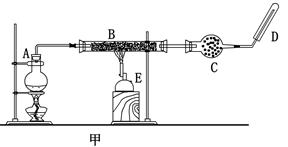
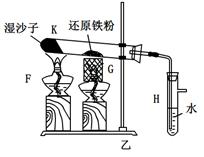
已知:B中放入的是铁与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒
精灯。对比两装置,回答下列问题:
(1)如何检查乙装置的气密性:。
(2)乙装置中湿沙子的作用是:。
(3)B处发生反应的化学方程式:。
(4)称取mg铁粉与适量石棉绒混合,然后加热至无气体放出。若收集的气体体积换算为标准状况为VL,铁粉的转化率为(列出计算式即可,不必化简)。
(5)为了证明反应后的固体混合物中含有+3价的Fe,该同学取出少量混合物于试管中,加入一定量的盐酸使固体混合物溶解,过滤,立即向滤液中滴加KSCN溶液,结果观察到溶液的颜色没变化。经过思考,该同学认为此现象不能说明反应后的固体混合物中不含有+3价Fe。他的理由是: _。