(10分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用带刻度的集气瓶排水法收集氢气,每隔1分钟记录一次数据(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)从0~3分钟时间段内,产生氢气的速率是如何变化的?答:___________________ ,造成这种变化的主要因素是____________;从3~5分钟时间段内,产生氢气的速率是如何变化的?
答:_________________,造成这种变化的主要因素是_________________。
(2)在盐酸中分别加入等体积的下列溶液,能减缓反应速率而又不减少产生氢气的量的是__________(双选题,漏选得1分,多选错选得0分)。
A.蒸馏水 B.CuSO4溶液 C.Na2CO3溶液 D.NaCl溶液
(3)在0~1、1~2、2~3、3~4、4~5分钟五个时间段中,反应速率最大的是在 分钟时间段内,在该时间段内盐酸的反应速率为 mol·L-1 min-1(设溶液体积不变,上述气体体积为标况下数据)。
某课外小组设计的实验室制取乙酸乙酯的 装置如图14-2所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
装置如图14-2所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。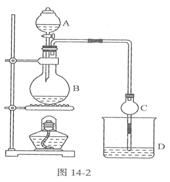
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
请回答:
(1)浓硫酸的作用是;若用同位素180示踪法确定反应产物水分子
中氧原子的提供者,写出能表示180位置的化学方程式:
。
(2)球形干燥管C的作用是。若反应前向D中加入几滴酚酞,现象:;反应结束后D中的现象是.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出;再加入(此空从下列选项中选择),然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
| A.五氧化二磷 | B.碱石灰 | C.无水硫酸钠 | D.生石灰 |
某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号),该错误操作会导致测定结果
(填“偏大”、“偏小”或“无影响”)__________________
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,测定结果(填“偏大”、“偏小”或“无影响”)___________________
(3)判断滴定终点的现象是:
(4)下图是某次滴定时的滴定管中的液面,其读数为mL
某化学学习小组对铝与酸和碱的反应进行探究,过程如下。
实验I:
(1)取形状、大小均相同的铝丝分别与等体积的、PH相同的盐酸、稀硫酸反应,随反应进行,盐酸中生成气体的速率明显比硫酸中生成气体的速率快,对此原因,你认为合理的猜测是下列的(填写相应的字母);
a. 盐酸的物质的量浓度大于硫酸的物质的量浓度
b. Cl-能促进此反应的进行
c. SO42-能抑制此反应的进行
d. 硫酸使铝发生钝化
(2)为了探究反应速率不同的原因,请你根据所提供的药品,填写实验方案中的空白部分。
药品:氯化钠固体、硫酸钠固体、硫酸铜固体、氯化铜固体、6mol/L盐酸、3mol/L硫酸、18.4mol/L硫酸、5mol/L硝酸。
方案:取两支试管,分别加入形状、大小均相同的铝丝和等体积的(填写相应的试剂,下同),再向其中的一支试管中加入适量的固体并振荡使固体溶解,观察实验现象。
实验探究:略。
实验II:
取足量的形状、质量均相同的铝丝分别与等体积的6mol/L的盐酸、6mol/L氢氧化钠溶液反应,待反应停止后取出剩余的铝丝洗净、干燥、称量,剩余铝丝的质量关系是前者后者(填“大于”或“小于”或“等于”);观察反应后的液体,发现铝与盐酸反应后所得的液体是黑色浑浊的,试管底部有少量黑色沉淀,对此现象,同学们进行了如下探究:
(1)提出猜想
同学们查找资料后获得如下信息:工业上用电解法冶炼铝所用的原料氧化铝是从铝土矿中提取的,所以得到的氧化铝中可能还含有微量的氧化铁和二氧化硅两种杂质,据此,同学们提出如下猜想:
猜想1:此黑色固体是铁单质,可能是电解得到的铝与杂质反应生成的,相应的化学反应方程式为;
猜想2:此黑色固体是硅单质,是电解得到的铝与二氧化硅反应生成的。
猜想3:此黑色固体是铝单质,是铝与盐酸反应时因反应过快而变成粉末分散到溶液中;
猜想4:此黑色固体可能是上述若干种单质组成的混合物。
(2)设计实验方案并完成相关实验:
将反应后所得的液体进行过滤、洗涤,分别取少量固体置于两支试管中,完成下列实验:
① 向其中的一支试管中加入足量的稀盐酸,观察固体是否溶解。实验时发现固体完全溶解,证明猜想一定不正确(填“1”、“2”、“3”、“4”)。
② 向另一试管中加入足量的氢氧化钠溶液,观察固体是否溶解。实验时发现固体完全溶解,证明猜想一定不正确(填“1”、“2”、“3”、“4”);
(3)得出结论
综合实验①②的现象,可推知猜想(填“1”、“2”、“3”、“4”)是正确的,固体溶解在氢氧化钠溶液中的离子方程式为:。
乱扔废旧电池会导致严重的环境污染,一节废电池就是一颗“炸弹”。某化学兴趣小组的同学在探究废干电池内的黑色固体回收利用时,进行了如图所示的实验:

查阅教材可得到下列信息:
①普通锌锰电池的黑色物质主要成分为MnO2.NH4Cl.ZnCl2等物质。
②Zn(OH)2能溶解于过量的氨水中。
请回答以下问题:
(1)操作③灼烧滤渣时所用到的主要仪器有酒精灯.玻璃棒..泥三角和三脚架;灼烧滤渣中的黑色固体时,产生一种使澄清的石灰水变浑浊的气体,由此推测滤渣中还存在碳。
(2)操作④的试管中加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色固体为。
(3)该同学对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
| 实验目的 |
操作 |
实验现象 |
结论 |
| 检验Cl- |
取少许滤液于试管中, |
含有Cl- |
|
| 检验NH4+ |
取少许滤液于试管中, |
含有NH4+ |
|
| 检验Zn2+ |
取少许滤液于试管中, |
含有Zn2+ |
(4)根据以上实验报告,关于滤液的成分,同学们的结论是:滤液中含有氯化铵和氯化锌,若想从滤液中得到溶质固体,还应进行得操作是。若要将所得的溶质固体中的物质加以分离,可用法。
[实验探究]已知稀溴水和氯化铁溶液都呈黄色。现在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因进行探究。
(1)仅限选用的仪器和试剂有:烧杯、试管、玻璃棒、量筒、滴管、药匙;酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液、硝酸银溶液、淀粉—碘化钾溶液。
完成以下实验探究过程:
[提出假设]
假设1:溶液呈黄色不是发生化学反应所致,是溶液中引起的(填微粒的化学式,下同)。
假设2:溶液呈黄色是发生化学反应所致,是溶液中引起的。
[设计实验方案]
为了验证上述假设1和假设2的推断,请用简要的文字说明你的实验方案:
验证假设1的方案:
本方案所用到的主要玻璃仪器有: 。
验证假设2的方案: 。
(2)根据高中所学的知识判断,你认为(填“假设1”或“假设2”)的推断是正确的;若选用淀粉-碘化钾溶液验证你的假设是否可行?(填“可行”或“不可行”),理由是 。
(3)若向稀溴化亚铁溶液中通入过量氯气,反应的离子方程式为。