(12分)A、B、C、D、E五种均为短周期元素,原子序数依次增大。A元素原子最外层电子数是核外电子层数的3倍,A与D同主族,A和D可形成化合物X’X可以使溴水褪色。A元素的单质和C元素的单质化合可生成Y, Y晶体中无分子,也无A、C的离子。A、B元素的单质一定条件下反应生成化合物M,D、B元素的单质反应生成化合物N,化合物M和化合物N的相对分子质量相等,且馅色反应均呈黄色。
请回答下列问题:
(1) 元素C的气态氢化物是________分子(填写“极性”或“非极性”)。
(2) B2D2的电子式是________________
(3) X可以使溴水褪色,该反应的离子方程式是________________________。
(4) 化合物M与化合物N的水溶液反应,若氧化剂与还原剂物质的量之比为1: 1,该反应的离子方程式是________
(5) 右图是BE晶体的一个“晶胞结构”示意图。下列说法正确的是________________。 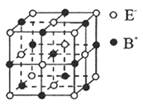
A. 与B+距离相等且最近的E_共有6个
B. —个BE晶胞中含有1个B +和1个E_
C. 与B+距离相等且最近的B+有8个
D. 与B+距离相等且最近的构成的空间结构是正八面体
(6) 将原子序数介于B、C两元素之间的单质、单质B与水反应所得的溶液构成原电池,负极的电极反应式是:O
分子式为 C5H12的某烃,它的一氯代物只有一种结构,则该烃结构简式为:
_______________________;按系统命名法命名,其名称为:_______________________。
(1)配平下列化学方程式(将系数填在横线上),并写出还原剂。
___NH3 +___O2 = ___N2 + ___H2O,该反应中的还原剂是_________。
⑵铁和稀硝酸反应,若反应后铁无剩余,则生成的盐可能是__________或____________或______________;若反应后硝酸有剩余,则生成的盐是___________;该反应的化学方程式为:____________________________________________。
化学式为 C2H6O 的有机物能与钠反应,它的名称是_________;俗名是______________。
有一包白色粉末,可能含有下列离子中的若干种。
阳离子:K+、Na+、Fe2+、Fe3+、Cu2+、NH4+、Mg2+;
阴离子:Cl-、SO42-、SO32-、CO32-、HCO3-、S2-、MnO4-;
进行如下实验:①取少量试样加水则全溶解,溶液呈无色透明 ②将所得溶液加入NaOH并加热,无可见现象 ③取少量原粉末加入盐酸,无可见现象
(1)从实验①可推知粉末中无离子;
(2)从实验②可推判不可能有离子;
(3)根据实验③可推判粉末中无离子,综上所述,该粉末中可能含有离子。
F可用作化肥,也可用来制炸药,化合物和单质间存在如下关系:
(1)写化学式:A,F。
(2)A→C转化的化学方程式:______________________
(3)试写出一种由E制得D的反应的方程式: