DAP-A树脂(下列路线图中的β、γ聚合物)是一种优良的热固性树脂,被用作高级UV油墨的一种成分。用UV油墨印刷的优点是:印刷时油墨极快干燥,对环境及人员无损害,性价比较高。因此,适于大规模生产食品、酒类、洗涤剂等包装纸盒。以下是以石油化工产品为原料,合成该材料的路线:
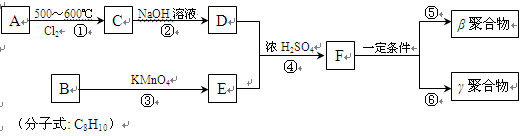
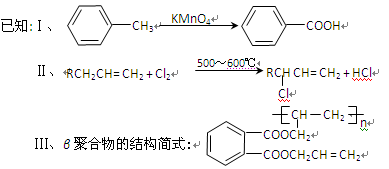
试回答下列问题:
(1)A的名称是 。
(2)在①~④的反应中属于取代反应的是 。
(3)B的结构简式是 ,B苯环上的二氯代物有 种。
(4)写出反应④的化学方程式:
。
(5)工业上可由C经过两步反应制得甘油(丙三醇),写出第二步反应的化学方程式
。
(6)γ聚合物和β聚合物相比,下列说法合理的是 。
| A.它们互为同分异构体 | B.它们含碳的质量分数相同 |
| C.γ聚合物中可能几乎不含碳碳双键 | D.不能发生水解反应 |
(12分) (1)已知丙酮[ CH3COCH3 ]键线式可表示为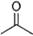 根据键线式回答下列问题:
根据键线式回答下列问题: 分子式:,结构简式:。
分子式:,结构简式:。
(2)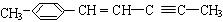 分子中最多有 个原子共直线;最多有个原子共平面。
分子中最多有 个原子共直线;最多有个原子共平面。
(3)写出乙烯分子的电子式:。
(4)有机物(CH3)2CHCH(C2H5)CH=CH2的名称是。
(5)写出甲苯制TNT化学方程式。
(6)  的一氯取代物有种,
的一氯取代物有种, 的二氯取代物有种。
的二氯取代物有种。
(12分)有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。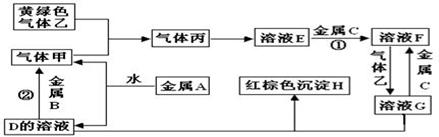
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A_____________;H ______________; G___________;乙____________。
(2)写出下列反应的化学方程式:
反应①___________________________________________________________;
反应②___________________________________________________________。
(8分)甲、乙、丙三种物质之间有如下转化关系:
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是
________ ;写出 乙→丙转化的化学方程式 :___________________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲物质是___________;写出 甲→乙转化的离子方程式_________________________________________。
(12分)以下表格中的实验是以CuSO4为例,分析电解质在溶液里所起反应的实质
(8分)下列各反应中,通入的气体反应物各起什么作用?请选择下列序号填空:
| A.只做氧化剂 | B.只做还原剂 |
| C.既做氧化剂又做还原剂 | D.既不做氧化剂又不做还原剂 |
(1)氯气通入水中:Cl2+H2O===HCl+HClO______________________
(2)二氧化氮通入水中:3NO2+H2O===2HNO3+NO__________________
(3)二氧化碳气体通入氢氧化钾溶液中:CO2+2KOH===K2CO3+H2O____________
(4)二氧化硫气体通入氢硫酸中:SO2+2H2S="==3S" +2H2O_____________________