在密闭容器中进行如下反应:X(g)+Y(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
| A.Z为0.3mol/L | B.Y2为0.4mol/L |
| C.X2为0.2mol/L | D.Z为0.4mol/L |
向一定量的Fe、FeO、Fe2O3混合物中加入100 mL 1 mol/L盐酸,恰好使混合物完全溶解,放出224 mL(标准状况下)的气体,在所得溶液中加入KSCN溶液,无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,可得到铁的质量是()
| A.11.2g | B.5.6g | C.2.8g | D.无法计算 |
X、Y、Z、M、N 代表五种金属。有以下化学反应:
①水溶液中:X+Y2+=X2++Y ②Z+2H2O(冷)=Z(OH)2+H2↑
③M、N 为电极与 N 盐溶液组成原电池,发生的电极反应为:M-2e— =M2+
④Y 可以溶于稀 H2SO4中,M 不被稀 H2SO4氧化. 则这五种金属的活泼性由弱到强的顺序是
| A.M<N<Y<X<Z | B.N<M<X<Y<Z |
| C.N<M<Y<X<Z | D.X<Z<N<M<Y |
已知室温下,Al(OH)3的Ksp远大于Fe(OH)3。向浓度均为0.1mol/L的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积关系,合理的是( )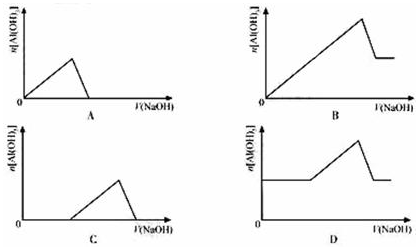
甲、乙两烧杯中各盛有100mL 3mol·L—1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲):V(乙)=1:2,则加入铝粉的质量为()
A 5.4g B 3.6g C 2.7g D 1.6g
38.4mg Cu跟适量的浓HNO3反应,Cu全部作用后,在标准状况下收集到22.4mL(不考虑NO2部分聚合成N2O4),则消耗HNO3的物质的量()
| A.1.0×10—3mol | B.1.6×10-3mol | C.2.2×10—3mol | D.2.4×10—3mol |