(4分)下列实验操作或实验所得出的结论正确的是 (填序号)。
A.镀锌层破损后 即对镀锌铁(白铁)制 即对镀锌铁(白铁)制 品失去保护作用 品失去保护作用 |
| B.制备Fe(OH)3胶体时,应向沸水中逐滴加入1 mol·L-1的FeCl3溶液,并继续加热到液体呈透明的红褐色为止 |
| C.用托盘天平称取5.85gNaCl,称量时砝码放在右盘,氯化钠放在左盘 |
| D.用灼烧闻气味的方法可以区别合成纤维和羊毛 |
E.用新制Cu(OH)2悬浊液与病人尿液共热,可检验尿液中是否含有葡萄糖
右图是某学生绘制的实验室蒸馏石油的装置图:
(1)指出仪器名称:AC
(2)指出装置图中错误之处,并加以改正
①
②
③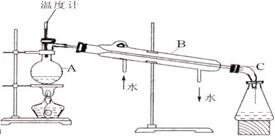
(3)实验操作分为以下五步:
① 将蒸馏烧瓶固定在铁架台上,然后在蒸馏烧瓶上装好带温度计的橡皮塞。
② 连接冷凝管,并把冷凝管用铁架台固定,然后将连接冷凝管进出水口的橡胶管的另一端与水龙头相连,并将出水口橡胶管的另一端放入水槽中。
③ 把酒精灯放在铁架台上,根据酒精灯的高度确定铁圈高度,固定铁圈,放好石棉网。
④ 用漏斗向蒸馏烧瓶内加入原油,再加入几块碎瓷片,然后在蒸馏烧瓶上装好带温度计的橡胶塞,连接好接受装置。
⑤ 检验装置的气密性(微热法)
正确的操作顺序是(填编号)
氢化钙固体是登山运动员常用的能源提供剂.某兴趣小组拟选用如下装置制备氢化钙.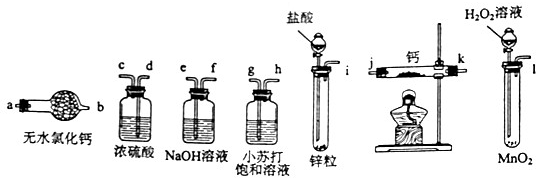
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为-
(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞 (请按正确的顺序填入下列步骤的标号).
| A.加热反应一段时间 | B.收集气体并检验其纯度 |
| C.关闭分液漏斗活塞 | D.停止加热,充分冷却 |
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此断,上述实验确有CaH2生成. ①写出CaH2与水反应的化学方程式
②该同学的判断不正确,原因是
(4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是
实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%%~30%的稀硫酸溶液,在50℃~80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口。静置、冷却一段时间后收集产品。
(1)写出该实验制备硫酸亚铁的化学方程式:__________________________________。
(2)采用水浴加热的原因是__________________________________________________。
(3)反应时铁屑过量的目的是(用离子方程式表示)____________________________。
(4)溶液趁热过滤的原因是__________________________________________________。
(5)塞紧试管口的目的是____________________________________________________。
(6)静置冷却一段时间后,在试管中观察到的现象是____________________________。
为了比较①H-OH,②CH3COOH,③CH3CH2—OH,④H2CO3,⑤苯酚五种物质分子中—OH上氢原子的活动性顺序,某课外活动小组设计了如下表所示的实验方案。请你利用有关实验仪器及给出的试剂,填写表中的空格,完成上述实验方案。可供选用的试剂有:紫色石蕊试液、金属钠、氢氧化钠溶液、碳酸钠溶液。实验中所需仪器自选。
| 实验步骤和操作 |
实验现象 |
结论(-OH上氢原子活动性顺序) |
| (1).五种物质各取少量于五支试管中,各加入紫色石蕊试液2~3滴 |
②、④变红,其它不变 |
②、④>①、③、⑤ |
| (2). |
||
| (3).①、③、⑤各取少量于试管中,各加入少量NaOH溶液 |
⑤由浑浊变澄清 |
⑤>①、③ |
| (4). |
(5).通过以上实验比较,从而得出这五种物质分子中—OH上氢原子的活动性由强到弱的顺序为(填序号)。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
⑴装置中导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
⑵该反应属于哪类反应类型。
| A.加成反应 | B.取代反应 | C.水解反应 | D.酯化反应 E.可逆反应 |
⑶酯化反应的断键特点是:
⑷写出制取乙酸乙酯的化学反应方程式:
⑸为了证明浓硫酸的作用,某同学进行了以下4个实验。实验开始先用酒精灯微热3 min,再加热使之微微沸腾3 min。实验结束后充分振荡小试管Ⅱ再测有机物的厚度,实验记录如表:
| 实验编号 |
试管Ⅰ中试剂 |
试管Ⅱ中试剂 |
有机层厚度/cm |
| A |
3 mL乙醇、2 mL乙酸、1 mL 18 mol/L浓硫酸 |
饱和Na2CO3溶液 |
5.0 |
| B |
3 mL乙醇、2 mL乙酸 |
饱和Na2CO3溶液 |
0.1 |
| C |
3 mL乙醇、2 mL乙酸、6 mL 3 mol/L硫酸 |
饱和Na2CO3溶液 |
1.2 |
| D |
3 mL乙醇、2 mL乙酸、一定浓度的盐酸 |
饱和Na2CO3溶液 |
1.2 |
实验D的目的是与实验C对照,证明H+对该反应的催化作用。实验D中加入盐酸的体积和浓度分别是mL和mol/L。