(l4分)向2L固定容积的密闭容器中加入一定量的NH3,H2和N2三种气体。一定条件下发生反应2NH3 N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
(1)能证明反应达到平衡状态的是 (填标号,下同)。
| A.容器内压强不再发生变化 | B.N2的体积分数不再发生变化 |
| C.容器内气体质量不再发生变化 | D.容器内气 体密度不再发生变化 体密度不再发生变化 |
(2)若tl="15" s,则t0-t1阶段以H2浓度变化表示的反应速率为 。
(3)t3-t4阶段改变的条件为 。
(4)上述反应的平衡常数K= (保留两位小数);向容器中再通入1.4molNH3、0.8 molH2,平衡 移动(填“向右”、“向左”或“不移动”)。
(5)25OC时,将a mol·L-1的氨水与0.1 mol·L-1的盐酸等体积混合。
①当溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,则反应的情况可能为
a.盐酸不足,氨水剩余 b. 氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb=  。
。
(14分)肉桂醛(C9H8O)是一种常用香精,在食品、医药化工等方面都有应用。肉桂醛与其他有机物具有如下转化关系,其中A为一氯代烃。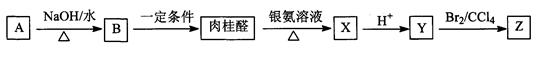
(1)肉桂醛是苯的一取代物,与H2加成的产物中没有支链,肉桂醛结构简式是_____,肉桂醛分子结构中有__________种不同化学环境的氢原子。
(2)反应A→B的化学方程式是____________________________________________,B转化为肉桂醛的反应条件为____________________。
(3)Z不能发生的反应类型是(填字母)___________。
a.取代反应 b.加聚反应 c.加成反应d.消去反应
(4)Y与乙醇在一定条件下反应的化学方程式是__________________________________。
(5)写出符合下列条件的Y的一种同分异构体的结构简式:_____________________________。
①属于酯类②苯环上只有一个取代基③能发生银镜反应。
有机物A常用于食品行业。已知9.0 g A在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验剩余气体为O2。
(1)A分子的质谱图如下图所示,从图中可知其相对分子质量为_____,则A的分子式是______________________。
(2)A能与NaHCO3溶液发生反应,A一定含有的官能团名称是______________。
(3)A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则A的结构简式是_________________________________。
(4)0.1 mol A与足量Na反应,在标准状况下产生H2的体积是__________L。
(5)A在一定条件下可聚合得到一种聚酯,用于制造手术缝合线,其反应的化学方程式是_______________________________________________________________。
(1)随着生活水平的提高,人们越来越关注营养平衡和自身的健康。
①有些学生从小偏食,不爱吃水果、蔬菜,结果营养缺乏、发育不良,
这主要是由于摄取(填“脂肪”、“维生素”或“蛋白质”)不足引起的。
②青霉素是医学上最早使用的天然素,在体内经酸性水解后得到青霉氨基酸其结构简式为: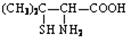 ,请写出青霉氨基酸可能具有的一种化学性质。
,请写出青霉氨基酸可能具有的一种化学性质。
③下列可作为食品着色剂的是A.食盐B.柠檬黄 C.青霉素
(2)①糖类、油脂、蛋白质都是人体必需的营养物质。油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和(写名称)。
②氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(—NH2)和(写名称)。人体中共有二十多种氨基酸,其中人体自身(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。
③淀粉在淀粉酶的作用下最终水解为(写化学式),部分该产物在体内被氧化放出能量,供人体活动需要。
(3)材料通常可分为金属材料、无机非金属材料、高分子合成材料等。
①三大合成材料是指:塑料、合成纤维和;塑料制品造成的环境问题通常称为。
②橡胶是制造轮胎的重要原料,天然橡胶通过措施可增大强度和弹性。
③钢铁在潮湿的空气中更容易被腐蚀,主要原因是其中的铁和碳构成许多微小的,发生电化学腐蚀。发生电化学腐蚀。钢铁发生电化学腐蚀时,负极的电极反应是。
(4)①居室装修所使的人造板材会释放出一种挥发性物质,长期接触会引起过敏性皮炎,免疫功能异常,该挥发性物质是。
②常用的污水处理方法有三种,分别是、中和法和沉淀法。
CO2作为未来碳源,既可弥补因石油、天然气等大量消耗引起的“碳源危机”,又可有效地解决温室效应。请回答下列问题:
(1)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)  CO(g)+3H2(g) △H =" +206" kJ·mol-1。将等物质的量的CH4和H2O(g)充入2 L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内H2的平均反应速率为。
CO(g)+3H2(g) △H =" +206" kJ·mol-1。将等物质的量的CH4和H2O(g)充入2 L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内H2的平均反应速率为。
平衡后可以采取下列的措施能使n(CO):n(CH4)增大。
A.加热升高温度
B.恒温恒容下充入氦气
C.恒温下增大容器体积
D.恒温恒容下再充入等物质的量的CH4和H2O
(2)工业上可以利用CO为原料制取CH3OH。
已知:CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H="-49.5" kJ·mol-1
CH3OH(g) +H2O(g) △H="-49.5" kJ·mol-1
CO2(g)+H2(g) CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1
CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1
①试写出由CO和H2制取甲醇的热化学方程式。
②该反应的△S0(填“>”或“<”或“=”),在 情况下有利于该反应自发进行。
(3)某科研人员为研究H2和CO合成CH3OH的最佳起始组成比n(H2) : n(CO),在l L恒容密闭容器中通入H2与CO的混合气(CO的投入量均为1 mol),分别在230°C、250°C和270°C进行实验,测得结果如下图,则230℃时的实验结果所对应的曲线是(填字母);理由是。列式计算270℃时该反应的平衡常数K:。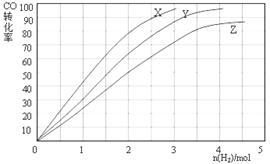
某无机化合物A由X、Y两种元素组成。在空气中充分灼烧得到含X元素的8g红棕色固体B,并产生能使品红褪色的气体C,将该气体全部通入足量的双氧水中得D溶液,再向D溶液中加入足量的BaCl2溶液,过滤、洗涤、干燥得46.6g固体。
(1)写出X在元素周期表中的位置,写出Y2-的结构示意图
写出B的化学式
(2)写出气体C通入H2O2中反应的离子方程式
(3)将A溶于D的稀溶液中得到E,并产生一种单质固体和一种气体,写出该反应的化学方程式
(4)将化合物E固体隔绝空气充分灼烧,使其分解,生成等物质的量的B、C和另一种化合物,则另一种化合物的分子式是;有同学认为该分解反应得到的固体产物中除B外,还可能会有含X元素的低价态物质,请判断该同学的观点是否合理理由是
(5)请设计实验证明E完全分解后的固体产物中是否含有X元素的低价态化合物