除去下表内各物质中含有的少量杂质,写出除杂试剂,并填写分离方法或反应的离子方程式。
| 序号 |
物质 |
杂质 |
所加试剂 |
分离方法 |
离子方程式 |
| (1) |
FeCl3溶液 |
FeCl2 |
|
(不需填写) |
|
| (2) |
Fe粉 |
Al粉 |
|
|
|
| (3) |
NaHCO3溶液 |
Na2CO3 |
|
(不需填写) |
|
按要求回答下列问题:
(1)金刚石、石墨燃烧的热化学方程式:
①C(s,金刚石)+O2(g) =CO2(g)△H = -395.4 kJ/mol
②C(s,石墨)+O2(g) =CO2(g)△H = -393.5 kJ/mol
则石墨转化为金刚石的反应热△H=。
(2)试写出硫酸铜溶液中加入过量浓氨水的离子方程式:。
(3)已知25℃时,CH3COOH的 Ka=1.8×10-5,H2CO3的Ka1=4.1×10-7 ,Ka2=5.6×10-11,
等物质的量浓度的下列溶液中,NH4+的浓度由大到小的顺序是(填序号)。
①CH3COONH4②NH4HCO3③ NH4HSO4④ NH4NO3
反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。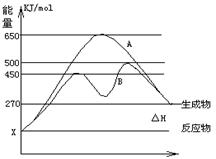
(1)据图判断该反应是______(填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率__ (填“增大”、“减小”或“不变”)
(2)其中B历程表明此反应采用的条件为___(选填下列序号字母),作出正确的判断的理由为
A、升高温度 B、增大反应物的浓度 C、降低温度 D、使用了催化剂
(3)若△H的数值为200KJ/mol,则x值应为 ___KJ/mol. 此反应在A反应历程中的正反应的活化能为 _____KJ/mol,
此反应在A反应历程中的正反应的活化能为 _____KJ/mol,
重晶石(主要成分是BaSO4)是制备钡化合物的重要原料,但BaSO4不溶于水也不溶于酸,这给转化为其他钡盐带来了困难,工业上用饱和Na2CO3溶液处理BaSO4沉淀,待达到平衡后,移走上层清夜,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。
Ksp(BaSO4)=1.0×10-10 Ksp(BaCO3)=5.0×10-10
(1)写出沉淀转化的方程式:,此反应平衡常数K的值为。
(2)要实现该转化C(CO32-)不低于mol/L
(3)必须更换Na2CO3溶液的原因是什么?
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH10 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CH3OH)= 0.8 mol/L,则CO的转化率为,此时的温度为(从上表中选择)。
④恒温、恒容时,下列情况不能说明反应I已经达到化学平衡状态的是________________。 a、容器各物质的浓度保持不变; b、容器内压强保持不变;
a、容器各物质的浓度保持不变; b、容器内压强保持不变; c、υ(CO)消耗==1/2υ(H2)生成 d 、容器内的密度保持不变
c、υ(CO)消耗==1/2υ(H2)生成 d 、容器内的密度保持不变
(2)25℃、101kPa时,燃烧16g液体甲醇生成CO2和H2O(l),放出的热量为363.26kJ,写出甲醇燃烧的热化学方程式:。
(3)某实验小组依据甲醇燃烧的反应原理,设计一个燃料电池电解Na2SO4溶液(图如下)。请根据图示回答下列问题: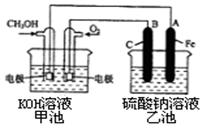
①通入甲醇蒸气的电极应为极(填写“正”或“负”),该电极上发生的电极反应是(填字母代号)。
a.2CH3OH —12 e- +3O2 ===2CO2 + 4 H2O
b.CH3OH—6 e- + 8 OH- ="==" CO32- + 6H2O
c.O2 + 2H2O + 4 e- ="==" 4OH-
d.O2— 4 e- + 4H+="==" 2H2O
②写出电极A的名称。写出B电极的电极反应式。
③当酸性甲醇燃料电池消耗3.36 L 氧气时(折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是。
在常温下,下列四种溶液中:
①0.1mol/L NH4Cl②0.1mol/LCH3COONH4③0.1mol/L NH4HSO4
④0.2mol/L NH3·H2O和0.2mol/L NH4Cl溶液等体积混合,溶液呈碱性
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示),其离子浓度由大到小的排列为_______________________
(2)比较上述四种溶液中NH4+的浓度大小(填序号)
(3)常温下,测得溶液②的PH=7,则说明CH3COO--的水解程度(填“大于”、“小于”或“等于”,下同)NH4+的水解程度,CH3COO--与NH4+浓度的大小关系是:c(CH3COO--)c(NH4+)。
(4)在溶液④中,离子的浓度为0.1mol/L;NH3·H2O和NH4+离子的物质的量浓度之和
为mol/L。