某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2—、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )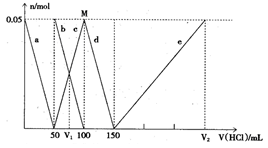
| A.原混合溶液中的CO32-与AlO2—的物质的量之比为1:2 |
| B.V1:V2=l:5 |
| C.M点时生成的CO2为0、05mol |
| D.a曲线表示的离子方程式为:AlO2—+H++H2O=Al(OH)3↓ |
常温下,下列各组微粒在指定溶液中一定能大量共存的是
| A.Kw/c(H+)=0.1mol/L的溶液:K+、Na+、SiO32-、NO3- |
| B.0.1 mol/L AgNO3溶液:H+、K+、SO42-、I- |
| C.加入苯酚显紫色的溶液:K+ 、NH4+、Cl-、I- |
| D.甲基橙呈红色的溶液中:MnO4- 、Al3+ 、C2H5OH 、SO42- |
下列有关实验原理或实验操作正确的是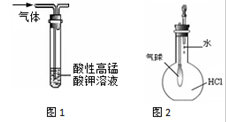
| A.用干燥pH试纸测定某新制氯水的pH |
| B.用25mL碱式滴定管量取20.00mL KMnO4溶液 |
| C.用图1装置除去乙烷中混有的乙烯 |
| D.用图2装置能验证HCl气体在水中的溶解性 |
下列叙述不正确的是
| A.根据金属活动性顺序表,可以推断冶炼金属时可能的方法 |
| B.CaCl2、MgCl2晶体都容易潮解,它们潮解的实质是晶体表面吸水形成溶液 |
| C.根据某元素原子的质子数和中子数,可以确定该元素的相对原子质量 |
| D.根据酸、碱、盐的溶解性表,可以判断某些溶液中的复分解反应能否进行 |
13.R、X、Y、M、Z五种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素,R与Z的最外层电子数相同下列叙述正确的是
| A.Z与M形成的化合物中不可能含有非极性键 |
| B.对应氢化物的热稳定性:X > Y >M |
| C.单质的还原性:R> M>Y>X |
| D.X、Y、M、Z四种元素组成的离子化合物受热易分解 |
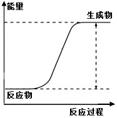
12.下列图示内容的对应说明错误的是
| A |
B |
C |
D |
|
图示 |
 |
 |
 |
 |
| 说明 |
该仪器用于配制一定质量分数的溶液 |
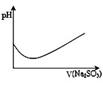
表示溴水中滴入Na2SO3溶液的PH 变化曲线 |
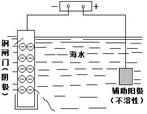
该装置可保护钢闸门不被腐蚀 |
该化学反应为吸热反应 |