科学家一直致力于“人工固氮”的方法研究。
(1)目前合成氨的技术原理为: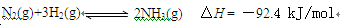
该反应的能量变化如图所示。
①在反应体系中加入催化剂,反应速率增大,E2的变化是: 。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应: 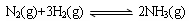
5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率v(N2)= ,H2的转化率为 ,该反应在此温度下的化学平衡常数为 。(后两空保留小数点后一位)
③欲提高②容器中H2的转化率,下列措施可行的是 。
| A.向容器中按原比例再充入原料气 |
| B.向容器中再充入惰性气体 |
| C.改变反应的催化剂 |
| D.液化生成物分离出氨 |
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为 。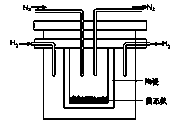
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应: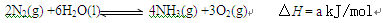
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K |
303 |
313 |
323 |
| NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
此合成反应的a 0。(填“大于”、“小于”或“等于”)
(本小题12分)A、B、C、D、E是五种短周期元素,原子序数依次增大。前四种的原子序数之和是E的原子序数的二倍。E的阳离子与D的阴离子都比A阳离子多2个电子层。D与四种元素中任意一种都可形成原子个数比不相同的若干种化合物。B是形成化合物种类最多的元素。请回答下列问题:
(1)写出元素符号:A________,E________。
(2)D在周期表中位于第_______周期第________族。
(3)五种元素原子半径由大到小的顺序是(用A~E字母表示)_______________。
(4)A、B、C、D可形成一种受热易分解的化合物,写出该化合物受热分解的化学方程式____________________________________________________________。
(5)A、B、D可形成A2B2D4型化合物,该化合物的名称是_____________。
据中国纺织流通协会数据统计,2006年8月份全国生产维纶纤维3424吨,与去年同比增长10.59%。维纶的成分是聚乙烯醇缩甲醛,它可以由石油的产品乙烯为起始原料进行合成,其主要步骤是由乙烯、氧气和醋酸合成酯酸乙烯酯,化学方程式如下:
CH2==CH2 + O2 + CH3COOH CH3COOCH==CH2+ H2O
然后再经过加聚、水解、缩合制得维纶。
(1) A→B的反应类型为________________。
(2)请确定A、B、D的结构简式:
A:________________B:________________ D:_______________。
(3)写出C的单体的的同分异构体的结构简式:________________。
根据元素周期表的结构,回答下面两个小题。
(1)A、B、C、D、X五种元素在周期表中的位置如右图所示(X与A、B为相邻族,与C、D为相邻周期),若元素X的原子序数为x,则A、B、C、D四种元素的原子序数之和为
或(用含x的代数式表示)。
(2)在下列各元素组中,除一种元素外,其余都可以按照某种共性归属一类,请选出各组的例外元素,并将该组其他元素的可能归属按所给六种类型的编号填入表内。
| 元素组 |
例外元素 |
其他元素所属编号 |
| (a)S、Na、Mg、N |
||
| (b)N、P、Sn、As |
||
| (c)K、Ca、Al、Zn |
||
| (d)Cu、Fe、Ag、Ca |
其他元素所属类型编号:①主族元素,②过渡元素,③同周期元素,④同主族元素,⑤金属元素,⑥非金属元素。
(本小题15分)A、B、C、D四元素的核电荷数依次增加,它们的离子的电子层数相同且最外层电子数均为8。A原子的L层电子数与K、M层电子数之和相等,D原子的K、L层电子数之和等于电子总数的一半。回答以下问题:
(1)四元素的符号依次是A______;B______;C________;D______。
(2)写出B、D元素的离子结构示意图:
B.______________________; D.______________________。
(3)用电子式表示A、C元素形成的离子化合物的过程:
________________________________________________________。
(4)在A、B、C、D最高价氧化物水化物中:
比较其中酸的酸性强弱:____________________________;
比较其中碱的碱性强弱:____________________________。
分别用A、B、C、D四块金属片做如图所示实验,实验数据如下:
| 金属片 |
电子流动方向 |
电压表读数 |
| A |
Cu←A |
+0.67 |
| B |
Cu→B |
-0.71 |
| C |
Cu←C |
+1.35 |
| D |
Cu←D |
+0.30 |
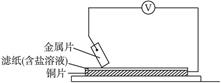
已知:构成两电极的金属活动性相差越大,电压表读数越大。请依据表中数据判断:
(1)_________金属可能是最强的还原剂。
(2)_________金属一定不能从硫酸铜溶液中置换出铜。
(3)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到有蓝色沉淀析出的是_________(填字母)。金属对应的原电池的电极反应为:负极: _________,正极: _________。